UD1. BIOELEMENTOS Y BIOMOLÉCULAS INORGÁNCIAS.
UD1. BIOELEMENTOS Y BIOMOLÉCULAS INORGÁNCIAS.
1. Los componentes químicos de la vida.
2. Bioelementos. Concepto y clasificación.
2.1. Clasificación de los bioelementos.
2.1.1. Primarios (C, O, H, N, S y P).
2.1.2. Secundarios o iónicos (dos ejemplos).
2.1.3. Oligoelementos (dos ejemplos).
EL ENLACE QUÍMICO EN LOS SISTEMAS BIOLÓGICOS
Iónico, covalente e intermoleculares.
3. Biomoléculas. Concepto.
3.1. Clasificación de las biomoléculas.
3.1.1. Inorgánicas.
3.1.2. Orgánicas.
4. Iones y biomoléculas inorgánicas: agua y sales minerales.
4.1. El agua en los seres vivos.
4.1.1. Importancia biológica.
4.1.2. Estructura (dipolo).
4.1.3. Propiedades y funciones.
4.2. Las sales minerales en los seres vivos.
4.2.1. Distribución.
4.2.2. Funciones: estructural (sales precipitadas) y reguladora (sales disueltas).
5. Fisicoquímica de las dispersiones acuosas: Ósmosis, difusión y diálisis.
6. Biomoléculas orgánicas: Tipos, estructuras, propiedades y funciones.
6.1. Glúcidos. Concepto. UD 2.
6.1.1. Monosacáridos: fórmulas lineales y cíclicas. Interés biológico.
6.1.1.1. Triosas: gliceraldehído y dihidroxiacetona.
6.1.1.2. Pentosas: ribosa, desoxirribosa y ribulosa.
6.1.1.3. Hexosas: glucosa, galactosa y fructosa.
6.1.2. Disacáridos. Enlace O-glucosídico.
6.1.2.1. Disacáridos de interés biológico: maltosa lactosa, sacarosa y celobiosa (no fórmula de la sacarosa).
6.1.3. Polisacáridos.
6.1.3.1. De reserva: almidón y glucógeno.
6.1.3.2. Estructural: celulosa.
6.2. Lípidos: Concepto. UD 3.
6.2.1. Lípidos saponificables (concepto).
6.2.1.1. Ácidos grasos saturados e insaturados.
6.2.1.2. Acilglicéridos: Enlace éster. Reacciones de esterificación e hidrólisis en los seres vivos.
6.2.1.3. Céridos: distribución en los seres vivos.
6.2.1.4. Fosfolípidos y glucolípidos.
-
Glicerofosfolípidos.
-
Fosfoesfingolípidos.
-
Glucolípidos.
-
Importancia en la formación de las membranas celulares.
6.2.2. Lípidos insaponificables.
6.2.2.1. Colesterol y derivados de interés biológico (hormonas y vitaminas).
6.3. Proteínas. Concepto. UD 4.
6.3.1. Aminoácidos: concepto y fórmula general.
6.3.2. Péptidos: enlace peptídico.
6.3.3. Propiedades: desnaturalización y especificidad.
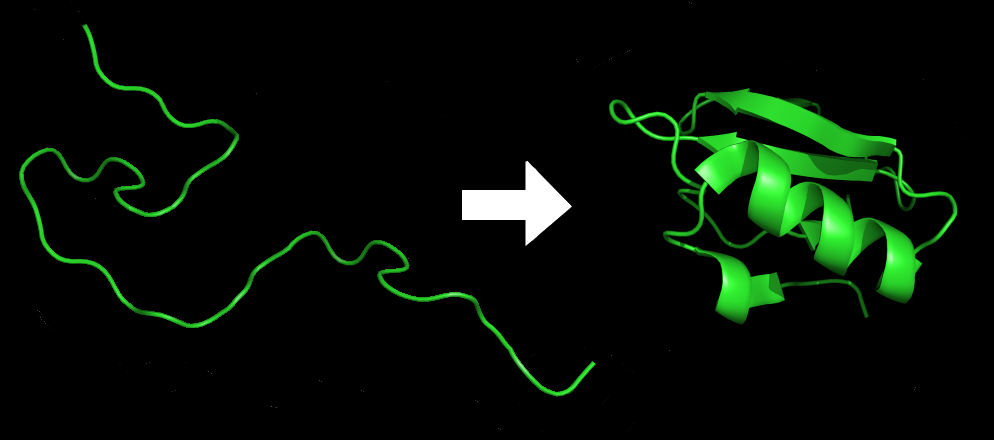
6.3.4. Niveles estructurales.
6.3.4.1. Estructura primaria.
6.3.4.2. Estructura secundaria (alfa-hélice y beta o lámina plegada).
6.3.4.3. Estructura terciaria (globular y filamentosa).
6.3.4.4. Estructura cuaternaria.
6.3.5. Funciones, indicando las proteínas más representativas.
6.3.6. Biocatalizadores. Concepto y tipos.
6.3.6.1. Enzimas: Naturaleza química de los enzimas. Cofactores y coenzimas.
6.3.6.2. Centro activo y actuación de las enzimas. Especificidad.
6.3.3.3. Factores que influyen en su acción. Inhibición enzimática: concepto y tipos.
6.3.3.4. Clasificación de los enzimas.
6.3.3.5. Vitaminas. Concepto, clasificación y funciones.
6.4. Ácidos nucleicos. Concepto. UD 5.
6.4.1. Fórmula general de un nucleótido.
6.4.2. ADN. Estructura primaria y secundaria (Modelo de Watson y Crick).
6.4.3. Función del ADN y relación con niveles superiores de empaquetamiento (collar de perlas y solenoide).
6.4.4. ARN. Tipos: estructura y función.
INTRODUCCIÓN
SOMOS POLVO DE ESTRELLAS
1. COMPONENTES QUÍMICOS DE LA VIDA.
- BIOLEMENTOS.
- BIOMOLÉCULAS INORGÁNICAS.
2. BIELEMENTOS. CONCEPTO Y CLASIFICACIÓN.
2.1 CONCEPTO.
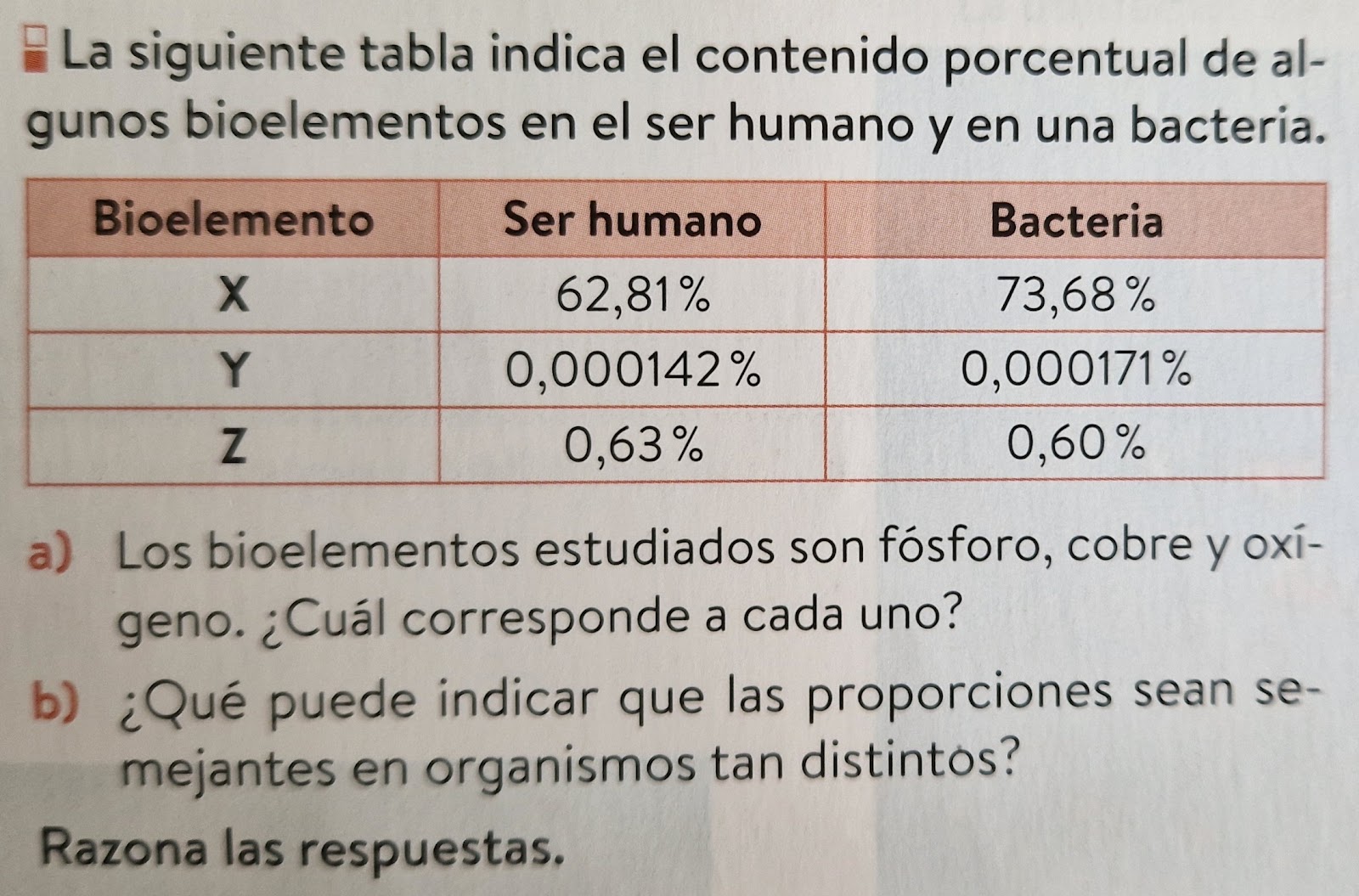
La Tierra está constituida por 118 elementos químicos distintos (92 naturales). De todos ellos, 70 forman parte de los seres vivos y sólo 25 son comunes e indispensables a todos ellos, estos son los Bioelementos.- Capas electrónicas externas incompletas que le permiten formar enlaces covalentes con facilidad y, por tanto, biomoléculas.
- Número atómico bajo, por lo que sus electrones compartidos en la formación de enlaces se hallan próximos al núcleo, otorgando estabilidad a las biomoléculas originadas.
- La electronegatividad de elementos como el O y el N permite que muchas moléculas sean polares y, por ello, solubles en agua (imprescindible para que tengan lugar las reacciones biológicas básicas). Pueden formar disoluciones y dispersiones e intervenir en procesos redox.
- Son fácilmente asimilables por los seres vivos por ser abundantes en las corteza, hidrosfera y atmósfera terrestre (donde se desarrolla la vida) en moléculas sencillas (CO2, H2O, nitratos...) fácilmente intercambiables entre los seres vivos y el medio.
Deben cumplir varias de estas propiedades, no sólo ser muy abundantes en la corteza terrestre. Por ejemplo, el Al, Fe y el Si son muy abundantes en la corteza terrestre pero sólo existen trazas de ellos en los seres vivos. Nombraremos al hablar del carbono al Si.
2.2. CLASIFICACIÓN.
3. OLIGOELEMENTOS: presentes en proporciones muy bajas, un 0'1% aproximadamente. No por ello son menos importantes, pueden jugar un papel esencial en los seres vivo. Destacamos el Fe, Cu, Mn, Co y el Zn = oligoelementos indispensables o esenciales pues están presentes en la mayoría de organismos. Otros como I, Li, F, Si, Mo o Al = oligoelementos variables por estar sólo presentes en determinados grupos de seres vivos. Se han identificado un total de 60 oligoelementos.
IDONEIDAD DE LOS BIOELEMENTOS PRIMARIOS.
IMPORTANCIA DEL CARBONO (Además del punto 1, incluye 2, 3 y 4)
- Como puedes ver en la imagen, pueden formar estructuras en las 3D del espacio.
- Pueden formar largas cadenas lineales, ramificadas o helicoidales y cíclicas. Dichas cadenas pueden presentar insaturaciones (dobles o triples enlaces) o pueden ser saturadas (sólo enlaces simples).
- Las características que hacen fundamental al C como constituyente de las biomoléculas orgánicas son aquellas como presenta como bioelemento primario:
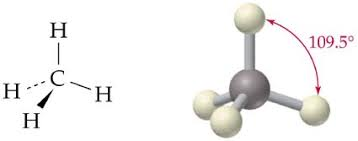
- Además de lo anterior, la propiedad que hace del C la molécula central de la vida es su TETRAVALENCIA (presenta 4 orbitales con electrones desapareados que se disponen en una estructura tetraédrica) de la cual derivan sus características más relevantes:
3. EL ENLACE QUÍMICO EN LOS SISTEMAS BIOLÓGICOS
- Intramoleculares. Se produce entre átomos. Son los enlaces iónicos y covalentes. Determinan la composición, identidad y propiedades químicas de la molécula. Además, las moléculas pueden unirse entre sí mediante enlaces
- Intermoleculares. Se producen entre moléculas. Son débiles, pero en conjunto suelen ser mas fuertes que el covalente. Determinan las propiedades físicas de las biomoléculas.
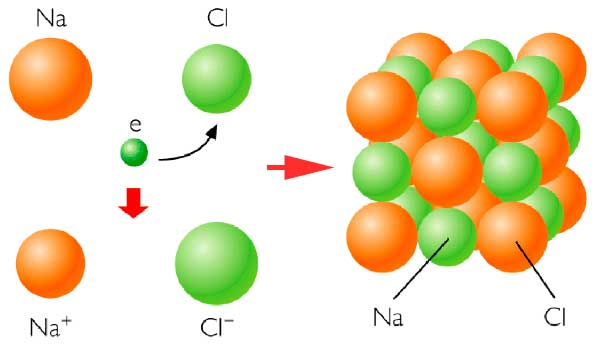
A. ENLACE IÓNICO (interacción electroestática entre aniones y cationes)
- El átomo que capta un electrón se convierte en un ion negativo (anión) mientras que
- el que lo pierde se transforma en un ion positivo (catión).
B. ENLACE COVALENTE: (se comparten uno o más pares de electrones)
- Los átomos de igual o parecida electronegatividad atraen los electrones más o menos por igual, y se forman moléculas apolares, por ejemplo, las de Cl2, N2, O2, e H2 y los compuestos orgánicos hidrocarbonados.
- En el caso de los átomos de electronegatividad distinta, unos atraen los electrones más que otros, por lo que se originan moléculas polares, con un polo positivo (+) y otro negativo (-); el resultado son los dipolos moleculares, como sucede por ejemplo con el H2O, NH3 y HCl.
-
Enlaces covalentes simples (comparten 2 electrones - uno de cada átomo - un par): H-H, C-H, C-O-, C-N=, C-S-, -S-S-.
-
Enlaces covalentes dobles (comparten 4 electrones - dos pares) : =C=C=, =C=O, O=O.
-
Enlaces covalentes triples (comparten 6 electrones - tres pares): -CC-, NN.
Los enlaces covalentes mantienen unidos los átomos en las biomoléculas orgánicas. Los enlaces glucosídico, peptídico, fosfodiéster, etc., que veremos más adelante, y que permiten la formación de diferentes moléculas glucídicas, proteicas, ácidos nucleicos, etc., son de tipo covalente.
B. ENLACES O INTERACCIONES INTERMOLECULARES:
C.1 ENLACE DE HIDRÓGENO O PUENTE DE HIDRÓGENO
Es el segundo tipo de enlace más importante en los sistemas biológicos, después del covalente. Es un enlace muy débil, de tipo electrostático y que se establece específicamente entre el átomo de H y otros átomos muy electronegativos, como F, O y N.
En este enlace, un átomo de H aparece unido a dos átomos distintos (pertenecientes a dos moléculas). Como el átomo de H sólo tiene un electrón no puede estar unido de forma covalente (donde se comparten pares de electrones) normal a los dos átomos. Lo que ocurre es que está unido a uno de los átomos covalentemente, pero debido a su pequeño tamaño queda próximo al otro átomo de moléculas adyacentes, estableciéndose una débil fuerza de atracción entre ellos. Este enlace asegura la cohesión entre las moléculas de agua, y contribuye en gran medida a la conformación espacial 3D (funcional) de las moléculas como las proteínas y los ácidos nucleicos.
C.2. INTERACCIONES IÓNICAS
Son debidas a la atracción entre moléculas que poseen un grupo funcional cargado eléctricamente, como -COO-, -NH3+ . Se da por ejemplo en las proteínas - estructura 3D funcional.
C.3. INTERACCIONES HIDROFÓBICAS
Se deben a que las moléculas apolares o no polares (que repelen el agua) en un medio acuoso tienden a agruparse entre sí. Por razones opuestas, las moléculas polares hacen lo propio y tienden a asociarse. Así, las porciones no polares de las macromoléculas tienden a agruparse por un lado y las porciones polares por otro. Estas interacciones son importantes en la constitución de las membranas celulares (bicapas lipídicas).
Son fuerzas atractivas inespecíficas que surgen del movimiento de los electrones en los átomos, lo que origina dipolos instantáneos. Son importantes en las uniones enzima-sustrato y de subunidades proteicas (estructuras terciaria y cuaternaria). Se dan cuando las moléculas están muy cercanas unas a otras y se deben a la interacción de regiones de carga levemente opuestas; la fuerza de unión de una sola interacción es muy débil, pero no ocurre así cuando es grande el número de interacciones.
C.5. PUENTE DISULFURO
Los puentes disulfuro se forman cuando reaccionan dos grupos tiol (-S-H), liberándose una molécula de hidrógeno molecular (H2) en el proceso. Aparecen en la estructura terciaria y cuaternaria de las proteínas. Los bioelementos no están generalmente en forma libre dentro del organismo, sino que se unen en moléculas más o menos grandes, denominadas biomoléculas, que constituyen los sillares arquitectónicos básicos para la construcción de la compleja estructura de los seres vivos. (ej Cabello liso & rizado)
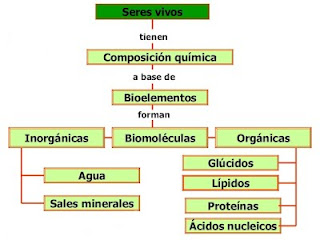
4. LAS BIOMOLÉCULAS: CONCEPTO Y CLASIFICACIÓN.
Las biomoléculas se clasifican en:
- Biomoléculas inorgánicas:
- Se encuentran en los seres vivos y también fuera de ellos.
- En muchos casos, no entra a formar parte de ellas el carbono.
- Complejidad estructural menor.
- Son el agua, los gases respiratorios y las sales minerales.
- Biomoléculas orgánicas:
- Son exclusivas de los seres vivos.
- Tienen un alto contenido en carbono.
- Complejidad estructural mayor.
- Son: glúcidos, lípidos, proteínas y ácidos nucleicos.
5. EL AGUA. ¿Cómo un molécula tan simple determina la vida?
- La especie.
- La actividad metabólica que desarrollan las células. Así, las esporas y semillas, que están en estado de vida latente contienen un 10 % de agua, mientras que el tejido nervioso, que presenta una gran actividad, tiene un 86 %. En los seres vivos o en las partes de los mismos que contienen estructuras minerales u orgánicas densas la proporción es más pequeña: el tejido óseo contiene sólo un 22% de agua.
- El porcentaje de agua varía también a lo largo de la vida de los organismos: el ser humano tiene en la infancia un 78%, y en la ancianidad un 60%.
- Intersticial (entre las células 8%),
- En forma de agua circulante (savia, sangre, linfa 15%) y
- Como agua intracelular 40% en humanos.
5.1. Estructura de la molécula de agua
La molécula del agua está formada por dos átomos de hidrógeno unidos a un átomo de oxígeno mediante sendos enlaces covalentes.
El átomo de oxígeno tiene dos pares de electrones no enlazantes, no compartidos (no se encuentran formando parte de ningún enlace químico) que se repelen entre ellos. Es además muy electronegativo por lo que atrae hacia sí los electrones compartidos con el hidrógeno (cada átomo de H comparte un par de electrones con el O). Todo ello genera en el hidrógeno una densidad de carga positiva ( +) y en el oxígeno una densidad de carga negativa ( -), puesto que los e- compartidos están desplazados hacia el átomo de O. Esta estructura de cargas se denomina dipolo permanente. Por ello decimos que el agua es una sustancia polar o dipolar, es decir, con desigual distribución espacial de cargas eléctricas. Así, aunque:
- La molécula de agua es neutra (tiene el mismo número de protones y de electrones), presenta una distribución de cargas asimétrica.
- La molécula de agua es plana (sus tres átomos se sitúan en el mismo plano), los pares de electrones (enlazados y no enlazados) de la molécula se disponen en el espacio formando un tetraedro, estructura tetraédrica. Geometría triangular depende de los pares de electrones no compartidos del átomo de O que al unirse al H forman un ángulo de 104,5º.
La naturaleza polar de las moléculas de agua hace que el oxígeno de una molécula (-), pueda interaccionar con el hidrógeno de otra (+), estableciendo lo que se denomina enlace o puente de hidrógeno.
- Este enlace es débil en comparación con un enlace covalente o iónico, lo que implica que puede formarse y deshacerse con cierta facilidad (debilidad que a veces se puede compensar por la formación de gran cantidad de enlaces). Su tiempo de vida es muy breve (1/10 elevado a 11) formándose y rompiéndose constantemente manteniendo las interacciones y permitiendo la elevada cohesión interna del agua.
- La estructura tetraédrica en la distribución electrónica hace que una molécula de agua pueda formar hasta cuatro puentes de hidrógeno, como sucede en el hielo.
La estructura que presenta la molécula de agua es la responsable de sus propiedades y de la gran importancia que desempeña para los seres vivos.
1. Elevada cohesión molecular. La íntima unión entre las moléculas de agua adyacentes, a través de los enlaces o puentes de hidrógeno, permite al agua ser un fluido dentro de un amplio margen de temperatura. Además, es incompresible, ya que mantiene un volumen constante a pesar de que se someta a fuertes presiones. Funciones - Por todo ello proporciona volumen a las células y turgencia a las plantas =constituye un esqueleto hidrostático. También para ciertos animales invertebrados (anélidos). Igualmente permite deformaciones citoplasmáticas = pseudópodos. Incompresible = líquido sinovial articulaciones.Como consecuencia de las propiedades físico químicas inherentes a su estructura el agua desempeña funciones imprescindibles para el mantenimiento de la vida:
1. Principal disolvente biológico (propiedad 8) El agua actúa como disolvente mediante el establecimiento de enlaces de hidrógeno con alcoholes, aldehídos o cetonas, provocando su dispersión o disolución. Además, al disociar compuestos iónicos, como las sales minerales, provoca su disolución.
2. Función metabólica (propiedad 8). El agua es el medio en el que se realizan la mayoría de las reacciones bioquímicas del metabolismo. En la hidrólisis participa activamente en la reacción. En la fotosíntesis aporta protones y electrones para la síntesis de moléculas orgánicas y produce el O2 atmosférico.
3. Función de transporte (propiedad 8). La elevada capacidad disolvente del agua permite el transporte de sustancias en el interior de los seres vivos y su intercambio con el medio externo (aporte de nutrientes y eliminación de sustancias de desecho).
Nota: incluir en apuntes - resumen tarea 2 (propiedad 8). Su característica como disolvente permite la formación de estructuras moleculares funcionales como bicapas lipídicas (anfipáticas) de las membranas celulares o el efecto hidrofóbico sobre sustancias apolares que contribuye al plegamiento de proteínas o la estabilización de la estructura del ADN.
- Función de Capilaridad - transporte de la sabia bruta - xilema. (propiedad 3) experimentalmente
4. Función estructural (propiedad 1). La elevada cohesión de las moléculas de agua permite dar volumen a las células, turgencia a las plantas, actuar como esqueleto hidrostático en algunos invertebrados y explica deformaciones que sufre el citoplasma celular.
5. Función mecánica amortiguadora (propiedad 1 y 2). Al ser un líquido incompresible. Evita que se dañen las estructuras celulares con golpes o fuertes tensiones. En ejemplo práctico que aplica esta propiedad es el líquido sinovial de las articulaciones de animales vertebrados, evitando el contacto entre huesos.
6. Función termorreguladora. (propiedad 4,5 y6) EL elevado calor específico del agua permite mantener constante la temperatura interna de los seres vivos. + Refrigeración (sudor)
7. Permite la vida acuática en climas fríos. (propiedad 7) Debido a su mayor densidad del agua en estado líquido, puede formarse una capa de hielo superficial al descender la Tª, la cual flota y protege de los efectos térmicos externos al interior de agua líquida que queda por debajo, permitiendo la supervivencia de muchas especies.
TAREA 2. Elaborar una tabla con propiedades y funciones del agua.
6.3 Disociación del agua - pH
El agua posee un bajo grado de ionización. De cada 107 moléculas, solo una se encuentra ionizada (protones hidratados H3O+ e iones hidroxilo OH-). Esto explica por qué la concentración de iones hidrógeno (H+) e hidroxilo (OH-) sea tan baja, de solo 10-7 moles/litro.
Aún así el agua se disocia en iones lo que hace que en realidad el agua pura sea una mezcla de tres especies en equilibrio químico: agua sin disociar (H2O), protones hidratados (H3O+), e iones hidroxilo (OH-):
H2O H+ + OH– (por comodidad escribiremos H+ en lugar de H3O+).
Esta disociación es muy débil. El producto iónico Kw a 25 °C es:
Kw = [H+][OH–] = 1,0·10–14 [H+]=[OH–]=10-7 moles/l
Determinadas sustancias, al disolverse en agua, pueden alterar la concentración de hidrogeniones, y entonces se utilizan los términos de acidez y alcalinidad.
- Una disolución acuosa es ácida cuando la concentración de hidrogeniones (H+) es mayor de 10-7 moles/litro;
- es alcalina cuando la concentración de hidrogeniones es menor de 10-7 moles/litro,
- y es neutra cuando la concentración de hidrogeniones es 10-7 moles/litro.
disolución neutra: pH = 7
-
disolución ácida: pH < 7
-
disolución alcalina o básica: pH > 7
La escala de pH es logarítmica. Por ejemplo:
-
pH = 3 significa que [H+]= 0’001 mol/litro.
-
pH = 4 significa que [H+]= 0’000 1 mol/litro.
-
pH = 5 significa que [H+]= 0’000 01 mol/litro.
Por tanto, una disolución a pH = 3 contiene 10 veces más hidrogeniones que una a pH = 4, y ésta 10 veces más que otra a pH = 5. En general, hay que decir que los procesos bioquímicos se desarrollan a valores de pH próximos a la neutralidad.
6. LAS SALES MINERALES.
- Precipitadas (insolubles en agua): Se encuentran de forma sólida y forman estructuras duras. Pueden formar parte de los huesos: fosfato de calcio (Ca3 (PO4)2); de la concha de los moluscos y crustáceos (Ca CO3), de las conchas de los diatomeas (Si O2), esmalte de los dientes (hidroxiapatita (un fosfato de calcio) el principal, además de iones de sodio, magnesio, flúor y carbonato), otolitos en el oído interno (min 1'34"), etc.
- Disueltas (solubles en agua): Están disociadas en sus iones, forman aniones (Cl-, NO3-, HCO3-) y cationes (K+, Na+, Mg2+, Ca2+). Algunas funciones que realizan las sales minerales disueltas son:
- Contribuyen a mantener el equilibrio osmótico en las células. Mantenimiento de la homeostasis.
- Colaboran en la transmisión del impulso nervioso.
- Forman disoluciones reguladoras del pH. (sistemas tampón o “buffer”)
- De manera individual, realizan acciones específicas, por ejemplo el Ca2+ interviene en la contracción muscular.
- Nota. Algunas sales se encentran Asociadas a sustancias orgánicas. Por ejemplo el Hierro (Fe2+) asociado a la hemoglobina permite el transporte de oxígeno en sangre o el grupo fosfato de los fosfolípidos de las membranas plasmáticas.
6.1 Sistemas reguladores del pH: sistemas tampón
El mantenimiento de la vida requiere que el pH de los fluidos celulares y orgánicos, como la sangre, se mantenga dentro de ciertos límites, ya que de lo contrario podría producirse un cambio de estructura de muchas biomoléculas (proteínas y ácidos nucleicos) y la alteración de muchas reacciones químicas en la que éstas intervienen. Para ello, en las soluciones acuosas de los seres vivos están presentes los llamados sistemas tampón o amortiguadores de pH, formados por disoluciones de ácidos débiles y de su correspondiente base conjugada (que actuarán cono dadores o aceptores de H+).La adición de pequeñas cantidades de H+, cuando se añade un ácido, o de OH–, cuando se añade una base, a uno de estos sistemas tampón no produce cambios de pH en un cierto intervalo. Ello se debe a que el ácido neutraliza los iones OH- y la base los H+.
- El tampón bicarbonato es común en los líquidos intercelulares. Mantiene el pH en valores próximos a 7,4 gracias al equilibrio entre el ión bicarbonato y el ácido carbónico, que a su vez se disocia en dióxido de carbono y agua:
- El tampón fosfato se encuentra en los líquidos intracelulares, y mantiene el pH interno celular en torno a 7,2 debido al equilibrio:
- Si el pH de la sangre desciende por debajo de 7,35 se produce acidosis. Está causada por la producción excesiva de ácidos en los tejidos, el fallo renal, las situaciones de inanición, ciertas enfermedades, como la diabetes, o la hipoventilación (ritmo respiratorio lento que incrementa la concentración de CO₂) provocada por algunas enfermedades pulmonares o la ingestión de ciertas drogas sedantes. Las consecuencias de la acidosis son depresión del sistema nervioso central que puede desencadenar el coma o llegar a causar la muerte.
- Si el pH de la sangre aumenta por encima de 7,45 se produce alcalosis. Puede estar provocada por los vómitos frecuentes y repetidos, la ingestión de ciertos fármacos o la hiperventilación (ritmo respiratorio rápido y agitado, como en los estados de ansiedad), que disminuye la concentración de CO₂ en sangre. La alcalosis puede llegar a generar sobreexcitación del sistema nervioso central, espasmos musculares, convulsiones y parada cardiorrespiratoria.
6.2 Carácter coloidal de la materia viva
La gran cantidad de agua contenida en la materia viva actúa como disolvente o fase dispersante para diversas moléculas de soluto que constituyen la fase dispersa.- Disoluciones verdaderas: Son mezclas homogéneas con moléculas de soluto con diámetro inferior a 10-7 cm, como las de los azúcares mono y disacáridos, sales minerales, aminoácidos.
- Dispersiones coloidales o coloides: son mezclas heterogéneas. El diámetro de las partículas de soluto está entre 10-7 y 10-5 cm, como las de las proteínas, lípidos, ácidos nucleicos, las cuales se verían al microscopio.
- Sol: tiene aspecto líquido debido a que hay mayor número de moléculas de disolvente que de soluto.
- Gel: aspecto semisólido y gelatinoso, ya que las moléculas de disolvente quedan atrapadas entre las de soluto, formando una red que actúa como fase dispersante impidiendo que el disolvente fluya. Ej. Colágeno, gelatina.
- Efecto Tyndall: Las dispersiones coloidales son transparentes, pero tienen cierta turbidez al ser iluminadas transversalmente, debido a la dispersión de la luz provocada por partículas coloidales de gran tamaño.
- Movimiento browniano: Movimiento desordenado provocado por el disolvente.
- Sedimentación: Las partículas coloidales se mantienen en suspensión, pero pueden sedimentar al ser sometidas a un campo gravitatorio fuerte.
- Elevada viscosidad: Debido a que contiene moléculas de gran tamaño. La viscosidad aumenta con la masa molecular o con el número de partículas coloidales.
- Elevada adsorción: Capacidad de atracción que ejerce la superficie de un sólido sobre las moléculas de un fluido.
- Diálisis: Separación de moléculas de una dispersión coloidal según su tamaño a través de una membrana semipermeable, que permite el intercambio de moléculas a ambos lados de la membrana.
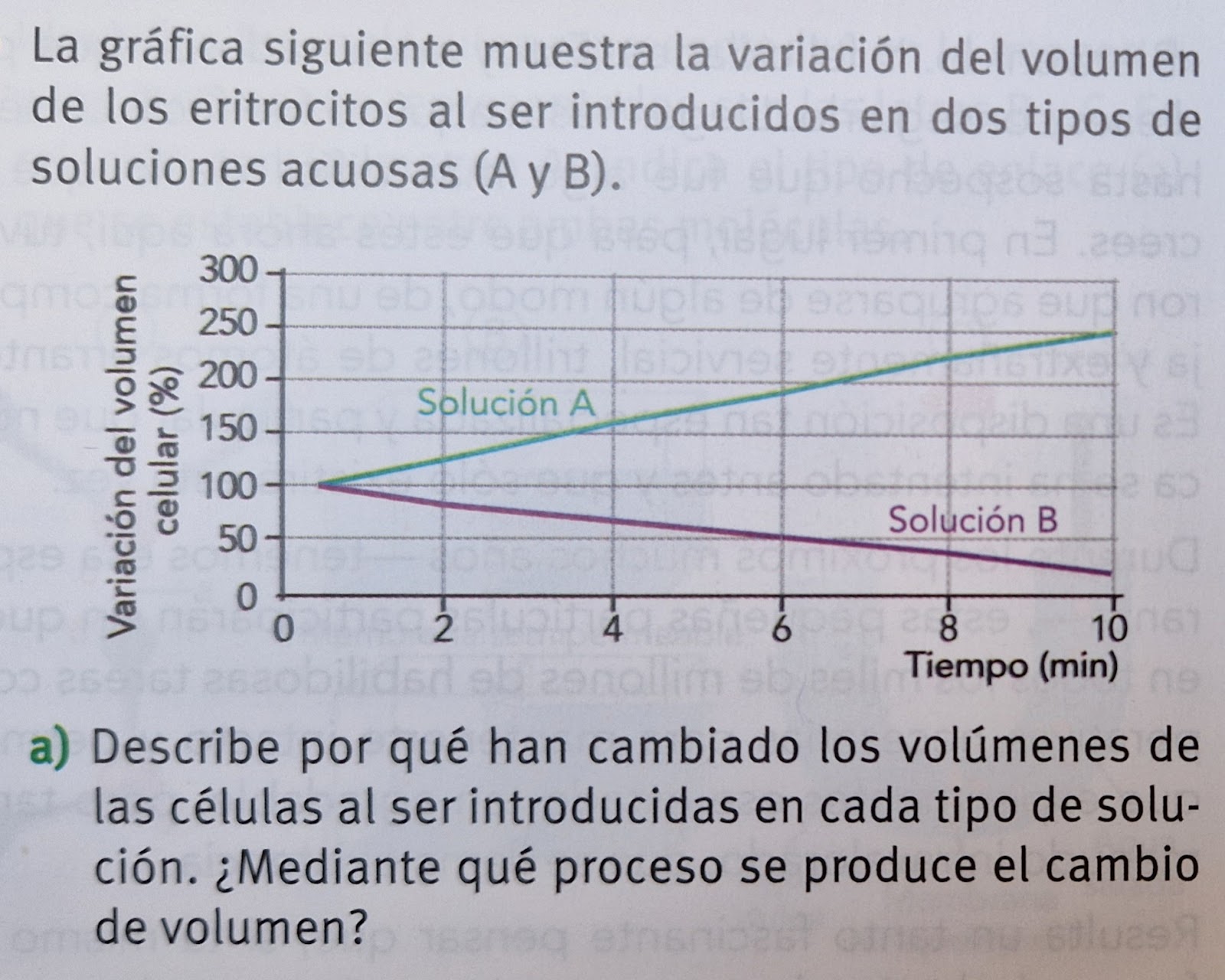
7. OSMOSIS, DIFUSIÓN Y DIÁLISIS.
Las partículas de soluto dispersas o disueltas en el agua pueden provocar tres fenómenos en relación con su movimiento en el seno de la misma: la difusión, la diálisis y la ósmosis.7.1 Concepto de difusión y diálisis
La difusión es el fenómeno por el cual las moléculas de un soluto se mueven continuamente en todas direcciones tendiendo a distribuirse uniformemente en el seno del agua hasta ocupar todo el espacio disponible. Las moléculas se mueven desde las zonas de mayor a menor concentración hasta que ésta sea la misma en todo el espacio de difusión.La diálisis es una difusión selectiva que separa uno o varios solutos de una disolución a través de una membrana cuya permeabilidad solamente permite el paso de las partículas más pequeñas.
La diálisis de la sangre o hemodiálisis sustituye a la filtración renal en las personas en las que ésta no funciona utilizando membranas artificiales. Se elimina así de la sangre urea y otros metabolitos y se mantienen las moléculas más grandes como las proteínas plasmáticas y las propias células sanguíneas.
7.2. Los fenómenos osmóticos
La ósmosis es el fenómeno por el cual tiende a igualarse la concentración de dos disoluciones separadas por una membrana semipermeable (es decir, que permite el paso de las moléculas de agua pero no las del soluto). Las moléculas de agua se mueven desde las zonas de mayor concentración de agua (agua pura o disoluciones diluidas) a las zonas donde la concentración de agua es menor (disoluciones concentradas, en las que las moléculas de agua están ligadas a las partículas de soluto). El flujo de agua a través de la membrana es por consiguiente asimétrico: pasa de la disolución diluida a la concentrada.La cantidad de agua que atraviesa una membrana semipermeable depende de la concentración de partículas disueltas a uno y otro lado, y no de su naturaleza.
La ósmosis genera una diferencia de contenido en agua a un lado y otro de la membrana, lo cual provoca una presión sobre la membrana que recibe el nombre de presión osmótica. Dicha presión equivale a la debería aplicarse sobre la membrana para neutralizar el flujo osmótico.
Cuando dos disoluciones de diferente concentración se hallan separadas por una membrana semipermeable, se denomina hipertónica a aquella disolución que está más concentrada, pues es la que generará más presión sobre la membrana; se denomina hipotónica a la solución más diluida, pues generará menos presión sobre la membrana; si las dos disoluciones tienen la misma concentración, se denominan isotónicas.
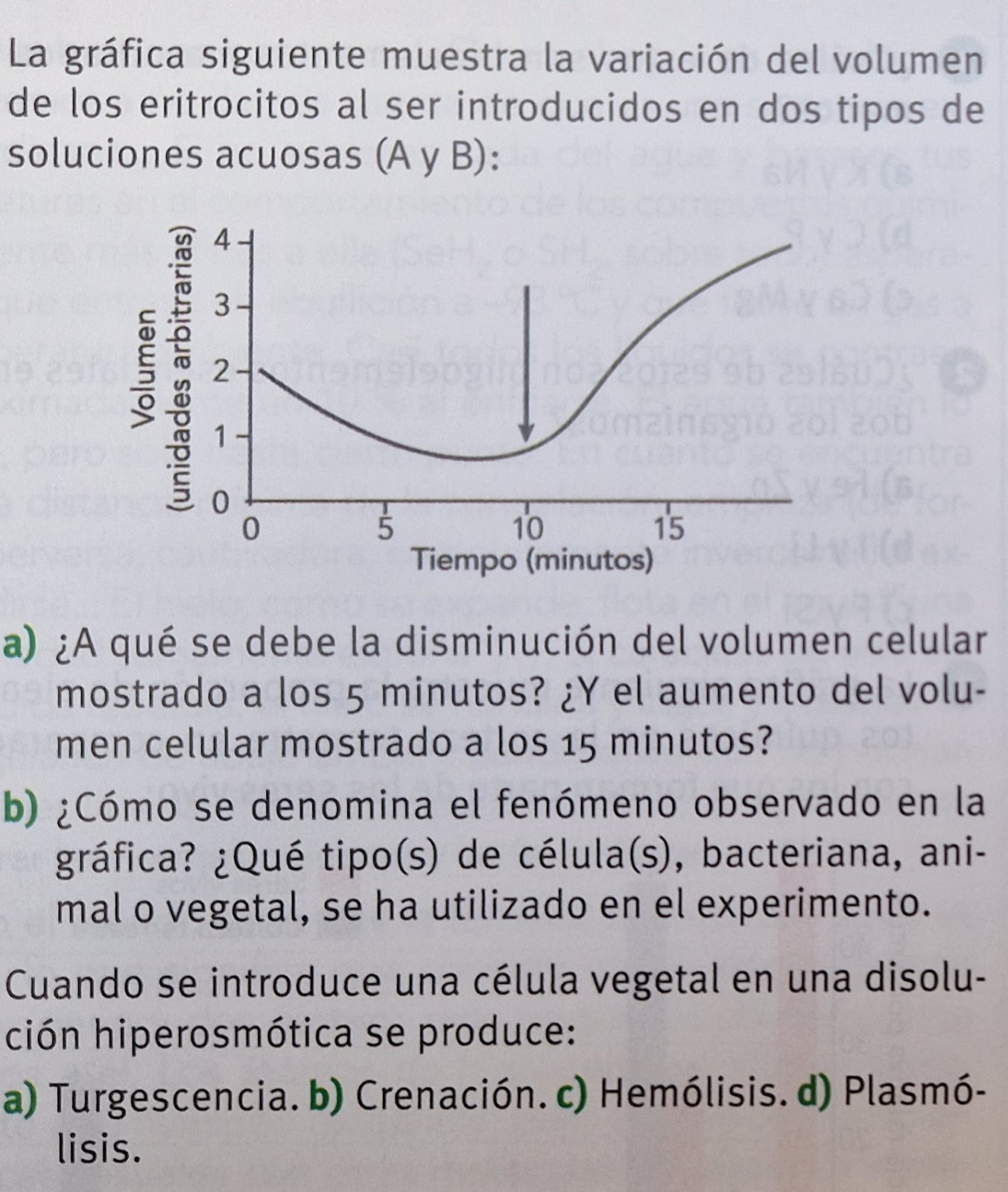
FENÓMENOS OSMÓTICOS
- Las membranas celulares funcionan como si fueran semipermeables; por tanto, el fenómeno de ósmosis puede provocar intercambios de agua entre el interior y el exterior de la célula. El resultado de dichos intercambios depende de la concentración de la disolución acuosa presente en el medio externo a la célula.
- Si el medio externo es hipertónico, el agua tenderá a salir de la célula. Las células animales pierden agua y se contraen. En las células vegetales, la vacuola y el citoplasma se contraen y la membrana plasmática se separa de la rígida pared celular, fenómeno que recibe el nombre de plasmólisis o crenación. En ambos casos, una pérdida excesiva de agua puede producir la muerte celular.
- Si el medio externo es hipotónico, el agua tenderá a entrar en la célula, y ésta se hinchará, fenómeno que, en las células vegetales, recibe el nombre de turgescencia. Las células sin pared, como las animales, expulsan iones para rebajar la presión osmótica interna aunque en algunos casos pueden llegar a reventar. En las células vegetales, la vacuola se hincha y presiona al citoplasma contra la pared celular. Sin embargo, no llega a reventar debido a que la fuerte pared celular que la contiene es algo elástica y puede estirarse un poco pero no se rompe. Cuando la pared ya no puede estirarse más, impide que siga entrando agua y la célula deja de hincharse.
- Si el medio externo es isotónico entra y sale la misma cantidad de agua.
Muchos fenómenos biológicos se deben a la ósmosis:
- Los protozoos de agua dulce tienen vacuolas contráctiles para bombear continuamente al exterior el exceso de agua que absorben por ósmosis.
- Algunos movimientos en las plantas, como el cierre rapidísimo de la trampa de la planta carnívora Venus atrapamoscas (Dionaea muscípula), se producen al perder agua las células turgentes que la mantienen abierta. El contacto con el insecto hace que esas células eliminen potasio al exterior lo que produce la salida de agua por ósmosis y la caída de la turgescencia. Un fenómeno semejante cierra las hojas de las mimosas cuando son rozadas. Puedes verlo aquí.
- Las raíces absorben agua cuando las disoluciones del suelo son hipotónicas respecto del citoplasma de las células de la planta. En caso contrario, el agua sale de la planta y ésta acaba secándose.
Resumen funciones de las Sales Minerales.
- Sales inorgánicas insolubles.
- Función de protección (conchas, caparazones de CaCO3 en crustáceos y moluscos o de Silicio en Diatomeas).
- Función de sostén. Esqueleto vertebrados.
- Otras funciones. Otolitos de oído interno
- Sales inorgánicas solubles.
- Funciones catalíticas. Forma de iones o cationes. Ej contracción muscular, impulso nervioso...
- Funciones osmóticas. Control de la distribución de agua intra y extracelular = genera y regula gradientes electroquímicos fundamentales en el mantenimiento del potencial de membrana y, por tanto, de procesos como la sinapsis neuronal. Diálisis y ósmosis inversa.
- Función tamponadora. Mantener el pH cte es fundamental - homeostasis.
- Función de nutrición. Algunos autótrofos usan sales como fuente de elementos de síntesis de biomoléculas orgánicas (ej NO2 o PO4)
Ejercicios competenciales
- Indica qué ocurriría si se inyectara agua destilada en sangre. También si bebieses agua pura o destilada.
- Explica los siguientes hechos:
- Para fabricar mermelada es imprescindible añadir azúcar a la fruta.
- El bacalao crudo salado se puede conservar bien fuera del frigorífico durante mucho tiempo.
- La carne como el jamón y la mojama se curan introduciéndolos en sal permitiendo su conservación fuera del frigorífico durante mucho tiempo.
- El arroz crudo se conserva perfectamente durante larguísimos periodos de tiempo.
PAU 2025
- a) ¿Qué ocurriría con estas células si se inyectara a un individuo una solución salina que hiciera que la concentración final de sales en sangre fuese del 2,2 %? [0,5].
- b) ¿Y si la concentración final de sales en sangre fuese del 0,01%? [0,5].
- c) Indique la composición de los fosfolípidos y explique por qué su estructura los hace idóneos para formar membranas biológicas [1]. Relacionado con UD
- a) ¿A qué fases de la mitosis corresponden A, B y C? [0,3].
- b) ¿Qué fase de la mitosis no se ha observado? [0,1]. Indique tres acontecimientos que ocurren en esta fase [0,6].
- c) Indique la importancia biológica que tiene la mitosis para este organismo [0,5].
- d) Sabiendo que la colchicina inhibe la polimerización de la tubulina, ¿Qué efectos tendría en la mitosis de estas células? Razone la respuesta [0,5].
PAU25 Ord Castilla la Mancha 2025.2.2. Los bioelementos son fundamentales para la estructura de nuestro cuerpo y para mantener estables nuestras funciones fisiológicas. Las funciones que realizan y la importancia de su equilibrio en el organismo ponen en valor la importancia de una dieta equilibrada y la alteración en nuestra salud que pueden provocar deficiencias o excesos de estos elementos.
a. ¿Qué son los bioelementos primarios? ¿Cuáles son?
b. ¿Por qué es fundamental el hierro para el organismo y qué consecuencias puede tener su deficiencia?
c. El Ca2+ es un catión que necesita ser transportado a través de la membrana a través de la membrana. Nombre y explique el mecanismo de transporte del Ca2+ a nivel de membrana.
- A. Defina el proceso físico-químico relacionado con las disoluciones acuosas que justifica esta observación. (1 punto)
- B. Teniendo en cuenta la concentración de solutos de las células de zanahoria y del medio externo, ¿describa qué está sucediendo en las células del vegetal? (1 punto)
- ¿Qué le ocurriría a un glóbulo rojo al introducirlo en agua destilada? ¿Ocurriría lo mismo si se introdujese en una disolución salina muy saturada? Razone su respuesta en ambos casos nombrando el proceso que ocurre en la célula. (2 puntos)
- Responde (1 punto cada apartado) A) Define difusión y diálisis. B) Aclara cómo controla el efecto de la ósmosis una célula vegetal (otro año se preguntó por definición de ósmosis)
- Funciones de las sales minerales y ejemplos de cada tipo. (2 puntos)
- Explica las funciones que llevan a cabo las sales minerales solubles en los seres vivos, a nivel de regulación osmótica y de pH, poniendo un ejemplo concreto por cada uno de los dos aspectos. (2 puntos)







































Comentarios
Publicar un comentario