UD 5. BIOCATALIZADORES. ENZIMAS Y VITAMINAS.
UD 5. BIOCATALIZADORES.
ENZIMAS Y VITAMINAS.
BLOQUE I “LA BASE MOLECULAR Y FISICOQUÍMICA DE LA VIDA”
UNIDAD 5: LAS ENZIMAS Y LAS VITAMINAS
-
Introducción
-
Las enzimas: biocatalizadores. Concepto
-
La actividad enzimática
-
El centro activo de las enzimas
-
La especificidad de las enzimas
-
Modelos de especificidad enzimática: Modelo de la “llave-cerradura” y del acoplamiento inducido.
-
Tipos de especificidad: absoluta, de grupo y de clase
6. Cinética de la actividad enzimática.
7. Inhibición enzimática
-
Inhibición reversible: competitiva, no competitiva y acompetitiva.
-
Inhibición irreversible
8. Factores que afectan a la actividad enzimática:
-
Concentración de sustrato
-
Temperatura
-
pH
10. Las vitaminas: concepto, clasificación y función
CONTENIDOS MÍNIMOS PARA EBAU
COORDINACIÓN DE BACHILLERATO 2023-2024.
1. Biocatalizadores. Enzimas. Concepto.
-
1.1. Naturaleza química de las enzimas (parte proteica y parte no proteica): grupo prostético, cofactores y coenzimas (NAD, NADP, FAD).
-
1.2. Propiedades de las enzimas: especificidad de sustrato y de reacción. Desnaturalización.
-
1.3. Nomenclatura de las enzimas (nombres tradicionales y empleo del sufijo -asa con el nombre del sustrato o de la reacción catalizada).
-
1.4. Centro activo Mecanismo de acción de las enzimas. Concepto de energía de activación y de complejo enzima-sustrato (ES).
-
1.5. Factores que influyen en la acción enzimática: pH y temperatura. Inhibición enzimática: concepto (no desarrollar los tipos).
2. Vitaminas. Importancia de las vitaminas y sales como cofactores enzimáticos y necesidad de incorporarlos en la dieta.
-
Vitaminas. Concepto, naturaleza química, clasificación (hidrosolubles y liposolubles) y funciones.
-
Relación con la salud y la enfermedad (hipovitaminosis e hipervitaminosis).
UNIDAD 5 BIOCATALIZADORES: LAS ENZIMAS
1. INTRODUCCIÓN
En las células se producen constantemente numerosos tipos de reacciones químicas; unas, encaminadas a sintetizar nuevas moléculas (anabolismo), y otras, a degradar las ya existentes (catabolismo). El conjunto de reacciones bioquímicas que se realizan el interior celular, para obtener la materia y la energía necesaria para llevar a cabo la actividad celular, se denomina metabolismo. Dado que las sustancias que intervienen son muy estables a temperatura ambiente, si no se les ayudara a interactuar, no reaccionarían o lo harían tan lentamente que no sería posible la vida. Esta dependencia de ayuda (actuación de las enzimas) es paradójicamente una gran ventaja, ya que, permite al organismo regular las reacciones que se han de dar, es decir, el control bioquímico del metabolismo.
2. LAS ENZIMAS: BIOCATALIZADORES
CONCEPTO: Las enzimas son los biocatalizadores (que acelera o retarda una reacción química. También son biocatalizadores vitaminas y hormonas) de los millares de reacciones químicas que constituyen el metabolismo. Éstas intervienen a concentraciones muy bajas y aceleran las reacciones en las que participan al disminuir la energía de activación de las mismas, sin sufrir por ello modificación alguna (no se consumen en el proceso). Y todo esto en condiciones determinadas de temperatura, presión, pH…
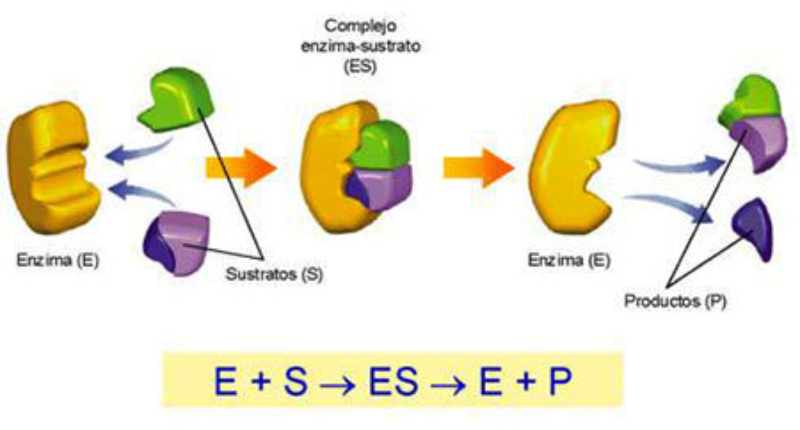
Se denomina sustrato (S) o reactivo (R) de la reacción a la molécula que va a reconocer la enzima (E) y que va a actuar sobre ella transformándola químicamente, la cual se convertirá en el producto (P) de la reacción catalizada por la enzima.
Las enzimas cumplen las dos CARACTERÍSTICAS de todos los catalizadores:
-
Son sustancias que, incluso en cantidades muy pequeñas, aceleran la velocidad de reacción. No es que se obtenga más P, sino que gracias a ellas se consigue la misma cantidad de P pero en menos tiempo.
-
No se consumen durante la reacción biológica, por lo que al finalizar ésta hay la misma cantidad de enzima que al principio, que puede volver a actuar.
Además, a diferencia de los catalizadores no biológicos o químicos, las enzimas presentan estas cuatro características:
-
Son muy específicas. Esto les permite actuar en una reacción determinada sin alterar otras, reconocer específicamente un sustrato, discernir formas D y L (isómeros), etc.
-
Actúan siempre a temperatura ambiente, es decir, a la temperatura del ser vivo. (campana de Gauss - desnaturalización)
-
Son muy activas. Algunas consiguen aumentar la velocidad de reacción más de un millón de veces, muy superior a los catalizadores no biológicos.
-
Presentan un peso molecular muy elevado. (Son complejos multiproteícos - Eª4ª - generalmente)
NATURALEZA QUÍMICA: son proteínas globulares, solubles en agua, que se difunden bien en los líquidos orgánicos, y que pueden actuar tanto a nivel intracelular, es decir, en el interior de la célula donde se han formado, como a nivel extracelular en la zona donde se segregan, como sucede con las enzimas digestivas. Existen enzimas formados por ARN (los ribozimas - por ejemplo los ARNr de los ribosomas en la traducción) pero son minoritarias.
Según su ESTRUCTURA, se pueden distinguir dos tipos de enzimas:
-
Holoproteínas = enzimas estrictamente proteicas: pueden estar constituidas por una o más cadenas polipeptídicas. Ejemplo la pepsina, peptidasa o proteasa.
-
Holoenzimas (enzimas conjugadas): Algunas enzimas, llamadas holoenzimas no poseen la estructura necesaria para realizar su función (apoenzima está inactiva). Para conseguirla han de unirse a otras moléculas no proteicas, los cofactores que fijados a su superficie con enlace covalentes y/o débiles aportan los grupos y funciones qª de las que carecen la parte proteica. La parte proteica se denomina entonces apoenzima. Holoenzima = apoenzima + grupo prostético o cofactor
-
Una FRACCIÓN POLIPEPTÍDICA, llamada APOENZIMA.
-
Una FRACCIÓN NO POLIPEPTÍDICA (llevan a cabo la catálisis en sentido estricto o activa a la apoenzima) que puede ser:
- Grupo prostético cuando su unión a la apoenzima es permanente, como ocurre en el grupo hemo de las enzimas citocromos-oxidasas.
- Cofactor cuando la unión a la apoenzima no es permanente (más común). Los cofactores tienen diversa naturaleza, y pueden ser:
- Inorgánicos como los cationes metálicos, de Zn2+, Ca2+, Fe2+, o Mg2+, que se unen a la apoenzima o regulan su activación = probablemente cambiando su configuración o Eª 3D.
- Orgánicos. Se denominan coenzimas cuando se unen débilmente a la apoenzima (NAD+, FAD, NADP+, vitaminas, etc.). Mira aquí
3. LA ACTIVIDAD ENZIMÁTICA
Cualquier reacción química (metabolismo) se inicia con la rotura de ciertos enlaces entre los átomos que constituyen las moléculas de los R, para formar posteriormente, los nuevos enlaces que originan las moléculas de los P. Ese estado en el que los enlaces de los R están debilitados o rotos, pero aún no se han formados los nuevos enlaces en los P, se conoce como estado de transición o estado activado.
Para alcanzar el estado de transición y, en definitiva, para que la reacción química tenga lugar, es necesario suministrar a los reactivos cierta cantidad de energía, denominada energía de activación. Esto ocurre tanto en reacciones endotérmicas como exotérmicas. La energía de activación es la energía mínima que necesita un sistema antes de poder iniciar una determinada reacción química. En definitiva, hay que suministrar energía de activación al R o S para romper o debilitar sus enlaces.
La acción catalizadora de las enzimas consiste en rebajar la energía de activación necesaria para llegar fácilmente al estado de transición y permitir que la reacción se lleve a cabo. En definitiva, sin la presencia de la enzima no es posible alcanzar el estado de transición para que se produzca la reacción. Por lo tanto, las enzimas ayudan a que se produzca la reacción química.
Como se dijo anteriormente la sustancia sobre la que actúa una enzima se denomina sustrato. Una reacción bioquímica, catalizada enzimáticamente, transcurre siempre mediante el siguiente mecanismo:
-
La unión específica del sustrato, o sustratos, al centro activo de la enzima,
-
La formación del complejo enzima-sustrato es imprescindible para llevara cabo la reacción química
-
La transformación química del sustrato o sustratos en el producto de la reacción por parte de la enzima
-
La liberación del producto o productos de la reacción de la enzima (la cual puede volver a actuar)
Cualquier reacción enzimática se puede representar mediante la siguiente ecuación:
E + S ES E + P
La E representa la enzima, la S el sustrato, la P el producto de la reacción, y la ES el complejo intermedio enzima-sustrato.
Algunas E no son activas hasta que sobre ellas actúan otras E o iones. Estas enzimas se denominan zimógenos o proenzimas. Un ejemplo es el pepsinógeno, que el HCl del estómago transforma en pepsina.
4. EL CENTRO ACTIVO DE LAS ENZIMAS
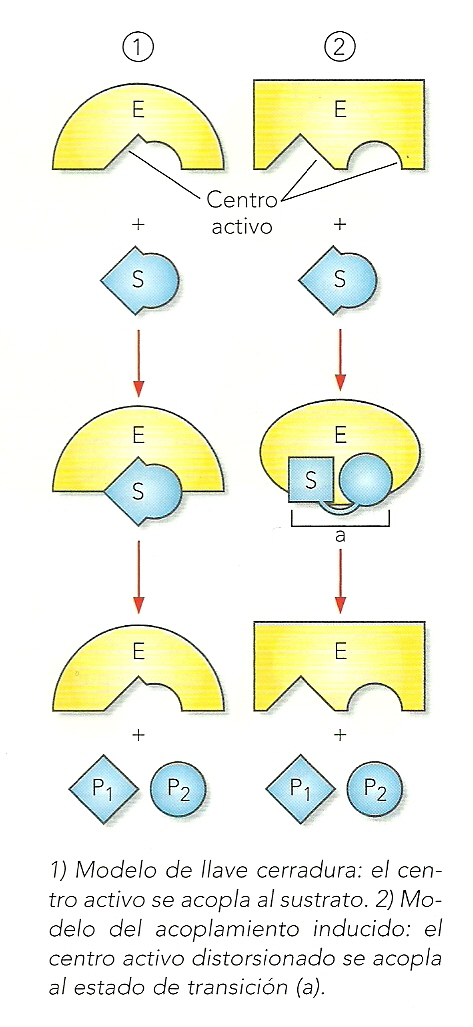
La actividad enzimática de las enzimas se inicia con la formación del complejo enzima-sustrato (ES). Esta unión se realiza gracias a los radicales de algunos/pocos aa que establecen enlaces con el sustrato, fijándolo y luego rompiendo alguno de sus enlaces y creando otros nuevos. La región de la enzima que se une al sustrato recibe el nombre de centro activo.
El centro activo de las enzimas tiene las siguientes características:
-
Constituyen una parte muy pequeña del volumen total de la enzima. Unos pocos de aa.
-
Tienen una estructura 3D en forma de hueco que facilita que el S encaje.
-
Están formados por aa que aunque distantes en la secuencia polipeptídica, debido a los repliegues de ésta, quedan próximos.
-
Los radicales de algunos de estos aa del centro activo presentan afinidad química por el S, por lo que lo atraen, lo fijan y establecen enlaces débiles con él. Esto facilita que una vez roto alguno de sus enlaces, los productos resultantes se puedan separar con facilidad del centro activo.
En la cadena polipeptídica de una enzima se pueden distinguir tres tipos de aminoácidos:
Aminoácidos estructurales. Son los que no establecen enlaces químicos con el S. Son los más abundantes y los responsables de la forma de la enzima, no tienen función dinámica. Por ejemplo, en la lisozima de 129 aminoácidos 124 son estructurales y sólo 5 no lo son.
-
Aminoácidos de fijación. Son los que establecen enlaces débiles con el S y lo fijan.
-
Aminoácidos catalizadores. Son los que al establecer enlaces débiles o fuertes (covalentes) con el S, provocan que se debilite su estructura molecular favoreciendo la rotura de algunos de sus enlaces (son el centro catalítico – proporcionan la energía de activación). Son, por tanto, los responsables de la transformación del sustrato en producto.
5. LA ESPECIFICIDAD DE LAS ENZIMAS
Sólo los sustratos que tienen la forma adecuada pueden acceder al centro activo; sólo los que pueden establecer algún enlace con los radicales de los aminoácidos fijadores pueden fijarse, y sólo los que presentan un enlace susceptible de ser roto, próximo a los radicales de los aminoácidos catalíticos pueden ser alterados. Todo ello origina una alta especificidad entre la enzima y el sustrato.
En 1890 E. Fischer propuso el modelo de llave-cerradura para ilustrar la complementariedad en la unión de la enzima al sustrato, equiparando esta complementariedad al símil de la llave (sustrato) y la cerradura (enzima). En la actualidad se ha visto que algunas enzimas al establecer los enlaces con el sustrato, modifican la forma de sus centros activos para adaptarse mejor, es decir, solamente son complementarias después de haberse unido a él; es el denominado modelo de acoplamiento inducido. En estos casos, en lugar del símil de la llave y la cerradura, es más adecuado el símil “como el guante (enzima) se adapta a la mano (sustrato)”, o el símil de “el encaje de manos entre dos personas”.
La especificidad puede darse en varios grados:
-
Especificidad absoluta. Se da cuando la enzima sólo actúa sobre un sustrato; por ejemplo, la ureasa sólo actúa sobre la urea.
-
Especificidad de grupo. Se da cuando la enzima reconoce un determinado grupo de moléculas; por ejemplo, la β-glucosidasa que actúa sobre todos los β-glucósidos.
-
Especificidad de clase. Es la menos específica, dado que la actuación de la enzima no depende del tipo de moléculas, sino del tipo de enlace. Por ejemplo, las fosfatasas separan los grupos fosfato de cualquier tipo de molécula.
6. LA CINÉTICA DE LA ACTIVIDAD ENZIMÁTICA
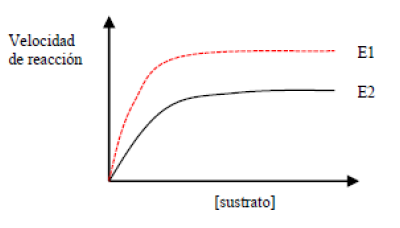
En una reacción enzimática con una concentración de enzima constante, al incrementar la concentración del sustrato se produce un aumento de la velocidad de reacción. Este incremento en la velocidad de reacción se debe a que, al haber más moléculas de sustrato por unidad de volumen, se aumenta la probabilidad de encuentro entre el sustrato y la enzima.
Si se va aumentando la concentración de sustrato, llega un momento en el que la velocidad de reacción deja de crecer, es decir, se llega a una velocidad máxima (Vmax). Esto se debe a que todas las moléculas de la enzima ya están ocupadas por moléculas de sustrato, formando el complejo enzima-sustrato, lo que se denomina saturación de la enzima. En la mayoría de las enzimas la representación gráfica de estos valores da una hipérbola. A partir de este comportamiento enzimático Leonor Michaelis y Maud Menten definieron una constante, denominada constante de Michaelis-Menten (KM), que es la concentración del sustrato a la cual la velocidad de reacción es la mitad de la velocidad máxima. La KM depende de la afinidad que hay entre la enzima y su sustrato. Basándose en ella propusieron la siguiente ecuación para que a partir de la Vmax y la KM, poder calcular la velocidad de la reacción enzimática según las distintas concentraciones de sustratos.
Se denomina número de recambio (turnover) o constante catalítica al número de moléculas de sustrato transformadas por unidad de tiempo y unidad estándar de actividad enzimática (U) a la cantidad de enzima que transforma 1 micromol de sustrato por minuto (µmol/min).
7. INHIBICIÓN ENZIMÁTICA
Determinadas sustancias se comportan como inhibidores enzimáticos. Los inhibidores son sustancias que disminuyen la actividad de la enzima o bien impiden completamente la actuación de la misma. Se trata de un proceso inverso a la activación enzimática. La enzima, previamente activa, disminuye su velocidad o incluso deja de actuar cuando aparece un inhibidor, el cual puede ser algún ión o alguna molécula orgánica, muy frecuentemente, el producto final de la reacción. En este último caso, en el que la enzima se inhibe cuando ya no se necesita obtener más cantidad de producto y la señal para ello es el propio producto, se habla de inhibición feedback o por retroalimentación.
Los inhibidores enzimáticos pueden ser perjudiciales o beneficiosos, por ejemplo, la penicilina es un inhibidor de las enzimas que regulan la síntesis de la pared bacteriana, por lo que, es útil contra las infecciones bacterianas. (beneficioso para el ser humano = medicamento, veneno para la bacteria)
La inhibición enzimática puede ser de dos tipos: reversible e irreversible. (tipos no entra en EBAU)
-
Inhibición reversible. La unión de los inhibidores con la enzima es temporal y la actividad enzimática se puede recuperar. La inhibición reversible puede ser de tres tipos:
Inhibición competitiva. El inhibidor es una molécula con una conformación espacial muy similar a la del sustrato, con el que compite por alojarse en el centro activo, impidiendo la unión y la posterior transformación del sustrato.
Inhibición no competitiva. En primer lugar actúa el inhibidor que se une a otra zona de la enzima distinta del centro activo y después provoca un cambio de conformación en la enzima, que da lugar a una disminución de su actividad.
Inhibición acompetitiva. El inhibidor se une al complejo enzima-sustrato e impide la formación del producto.
-
Inhibición irreversible. Todos los inhibidores responsables de este tipo de inhibición son compuestos o venenos que se unen irreversiblemente a determinados grupos del centro activo de la enzima alterando su estructura y anulando la capacidad catalítica de la enzima de forma permanente. Un ejemplo sería el caso de los insecticidas organofosforados que son inhibidores de la enzima acetilcolinesterasa = neurotransmisor del sistema neuromuscular.
8. FACTORES QUE AFECTAN A LA ACTIVIDAD ENZIMÁTICA
La velocidad de reacción conseguida por una enzima, depende de factores como la concentración de sustrato, la temperatura o el pH.
-
Concentración de sustrato. Al aumentar la concentración de S, existen más centros activos ocupados y la velocidad de la reacción aumenta hasta que no quedan centros activos libres; a partir de ese momento, un aumento de la concentración de S no supone un aumento de la velocidad de reacción (Vmax según MM).
-
Influencia de la temperatura. Si a una reacción enzimática se le suministra energía calorífica, las moléculas aumentan su movilidad y el número de encuentros moleculares entre el S y la E aumenta, por lo que aumenta la velocidad de reacción. Existe una temperatura óptima a la cual la actividad enzimática es máxima. Si la temperatura aumenta y sobrepasa la temperatura óptima, se dificulta la unión E-S y a partir de cierta temperatura la E se desnaturaliza, pierde su estructura secundaria, terciaria y cuaternaria y por tanto, su actividad enzimática.
-
Influencia del pH. Las enzimas presentan dos valores límite de pH entre los cuales son eficaces; traspasados estos valores las enzimas se desnaturalizan y dejan de actuar. Entre los dos límites de pH existe un pH óptimo en el que la enzima presenta su máxima eficacia.
9. CLASIFICACIÓN DE LAS ENZIMAS
Para denominar una enzima se cita primero el nombre del sustrato, a continuación, el nombre de la coenzima, si la hay, y finalmente la función que realiza, terminado en -asa. Por ejemplo, la enzima succinato flavín deshidrogenasa. Generalmente, lo más normal es que sólo se utilice el nombre del sustrato acabado en – asa. Por ejemplo, sacarasa, maltasa, amilasa, etc. Sin embargo, algunas enzimas conservan su antigua denominación como por ejemplo, la tripsina, pepsina, etc.
Existe una nomenclatura oficial formada por un código de 4 cifras precedido de las letras EC (Enzyme Commission) que indica la clase, subclase, subdivisión de la subclase y cifra específica. EC 2.7.3.2 = ATP-creatín-fosfotransferasa.
Según la función que realizan, las enzimas se clasifican en seis clases:
I. Oxidorreductasas. Catalizan reacciones de oxidación o reducción del sustrato. Los principales tipos son las deshidrogenasas y las oxidasas.
-
Deshidrogenasas. Separan átomos de hidrógeno del sustrato. Utilizan coenzimas como el NAD+, NADP+ o FAD. Por ejemplo la NAD-reductasa de la cadena respiratoria.
-
Oxidasas. Oxidan el sustrato al aceptar sus electrones. Por ejemplo, las citocromos oxidasas de la cadena respiratoria.
II. Transferasas. Transfieren radicales de un sustrato a otro sin que en ningún momento queden libres dichos radicales. Por ejemplo la glucoquinasa que transfiere un grupo fosfato desde el ATP a la glucosa (ej de G + ATP ---- G6P + ADP)
III. Hidrolasas. Rompen enlaces mediante la adición de una molécula de agua que se escinde y aporta un –OH a una parte y un –H a la otra parte. A este grupo pertenecen las enzimas digestivas como son las peptidasas (rompen enlaces peptídicos), amidasas (rompen enlaces C-N), lipasas (rompen enlaces éster), etc.
IV. Liasas. Separan grupos sin intervención de agua (sin hidrólisis) generalmente originando dobles enlaces en la molécula, o bien añadiendo grupos (CO2, H2O, -NH2) a moléculas con dobles enlaces (-C=O-, -C=C-) que generalmente los pierden. Por ejemplo las desaminasas retiran grupos amino originando dobles enlaces.
V. Isomerasas. Catalizan reacciones de isomerización, es decir, de cambio de posición de algún grupo de una parte a otra de la misma molécula.
VI. Ligasas o sintetasas. Catalizan la unión de moléculas o grupos mediante la energía proporcionada por desfosforilación de ATP. A este grupo pertenecen la mayor parte de las polimerasas (ADN Pol por ejemplo)
10. LAS VITAMINAS: CONCEPTO, CLASIFICACIÓN Y FUNCIÓN
Las vitaminas son biomoléculas orgánicas de naturaleza química muy variable (heterogéneas). Tienen una gran importancia por su participación en los procesos metabólicos como coenzimas (grupo prostético de las enzimas). Su carencia, por tanto, impide una adecuada acción de las enzimas correspondientes y puede producir importantes alteraciones metabólicas.
Las vitaminas son moléculas muy lábiles, es decir, pueden alterarse fácilmente por el calor, los cambios de pH e incluso el propio O2 del aire o la luz que provocan su destrucción.
Los animales no son capaces de sintetizarlas, por lo que debemos obtenerlas de los alimentos de origen vegetal. Para los animales son nutrientes esenciales, como son algunos ácidos grasos insaturados y algunos aminoácidos. También algunos productos animales crudos como la leche, el queso, etc. son fuente de vitaminas ya que las tienen acumuladas.
Las necesidades diarias de vitaminas son en realidad muy pequeñas (se requieren en cantidades mínimas, del orden de mg o µg/día). Una dieta variada y rica en alimentos frescos es suficiente para satisfacer esta demanda. Las necesidades de algunas vitaminas pueden satisfacerse con la ingestión de otras moléculas denominadas provitaminas, que tras un pequeño cambio químico, llevado a cabo en el organismo, originan la vitamina activa. Por ejemplo: provitamina D3 se transforma en la piel por actuación de la irradiación ultravioleta, de los rayos solares, en vitamina D3. Otro ejemplo es el beta-caroteno que es transformada en vitamina A.
El déficit de vitaminas en la alimentación puede generar trastornos y enfermedades carenciales graves. Se trata de las avitaminosis (carencia tatal, poco común) e hipovitaminosis. Un consumo excesivo de vitaminas acarrea hipervitaminosis que, aunque menos frecuente, puede aparecer en personas que ingieren preparados farmacéuticos con dosis muy altas de esas sustancias (sólo en vitaminas liposolubles)
NOMENCLATURA DE LAS VITAMINAS: antiguamente las vitaminas se denominaban según la enfermedad que producía su carencia (antirraquítica, antiescorbútica, etc.). Posteriormente se utilizaron letras para nombrarlas (C, D, etc.). En la actualidad se va imponiendo su nombre químico (ácido ascórbico, tocoferol,…).
CLASIFICACIÓN DE LAS VITAMINAS
La composición química de las vitaminas es variada pero se pueden clasificar en dos grupos, atendiendo a su solubilidad en agua:
-
Las vitaminas LIPOSOLUBLES son lipídicas y, por ello, son insolubles en agua. Se acumulan en el hígado y otros lugares del tejido adiposo. Pueden producir enfermedades por hipervitaminosis al acumularse.
-
Las vitaminas HIDROSOLUBLES, por el contrario, son solubles en agua y no se acumulan en los tejidos grasos. Enfermedades por hipovitaminosis.
|
VITAMINAS LIPOSOLUBLES |
||
|
Vitamina |
Función |
Efectos de la deficiencia |
|
A o retinol (vegetales, lácteos e hígado) |
Antioxidante Participa en el proceso de la visión de las células fotorreceptoras de la retina Interviene en el mantenimiento de los tejidos epiteliales |
Ceguera nocturna o total. Sequedad en la piel. |
|
D o calciferol (lácteos, huevos, luz UV, aceite hígado pescado) |
Mineralización de los huesos Absorción de Ca2+ y P en el intestino |
Raquitismo. |
|
E o tocoferol (margarina, semillas, verduras hoja verde) |
Antioxidante (protección contra la oxidación de ácidos grasos y mb celulares) |
Anemia |
|
K o naftoquinona (verduras hoja verde) |
Síntesis de protrombina, necesaria para una adecuada coagulación de la sangre |
Inhibición coagulación |
|
VITAMINAS HIDROSOLUBLES |
||
|
Vitamina |
Función coenzimática |
Efectos deficiencia. |
|
B1 o tiamina (visceras, cerdo y legumbres) |
En forma de pirofosfato de tiamina actúa como coenzima de las enzimas descarboxilasas |
Beri-beri (debilidad muscular, insuficiencia cardíaca, crecimiento retardado, depresión...) |
|
B2 o riboflavina (lácteos, hígado, huevos, cereales, legumbres) |
Origina las coenzimas NAD+ y NADP+ que participan en las reacciones metabólicas de oxidación-reducción |
Inflamación ocular. |
|
B3 o nicotinamida (hígado, carne magra, cereales, legumbres) |
Origina las coenzimas FMN y FAD que participan en las reacciones metabólicas de oxidación-reducción |
Pelagra (dermatitis, diarrea, llagas en la piel y cavidades gástricas...) |
|
B5 o ácido pantoténico (lácteos, hígado, huevos, cereales, legumbres) |
Forma parte de la coenzima A, la cual transporta grupos acilo |
Fatiga, perdida de coordinación. |
|
B6 o piridoxina (cereales, verduras y carnes) |
El fosfato de piridoxal (derivado de esta vitamina) es la coenzima de las enzimas transaminasas |
Convulsiones, irritabilidad, anemia, cálculos renales... |
|
B8 o biotina (carne, verduras y legumbres) |
Actúa como coenzima de las enzimas carboxilasas |
Depresión, fatiga, nauseas... |
|
B9 o ácido fólico (integrales, hoja verde y legumbres) |
En forma de ácido tetrahidrofólico participa en reacciones de síntesis de las bases nitrogenadas |
Enrrojecimiento de la lengua, fatiga, diarrea, debilidad. |
|
B12 o cianocobalamina (carnes rojas, huevos y lácteos) |
En forma de desoxiadenosil cobalamina interviene en reacciones del metabolismo de proteínas y de ácidos nucleicos |
Temblores, perdida de peso y apetito, ardor en la lengua, fatiga... |
|
C o ácido ascórbico (cítricos, verduras y tomate) |
Participa en reacciones de hidroxilación |
Escorbuto (hemorragias y caída de dientes) gingivitis, debilidad general, hemorragias... |
Ejemplo competencial vitaminas.
"Ejercicio. Miércoles 28 de noviembre, desembocamos por el Estrecho para entrar en el gran mar, al que dimos en seguida el nombre de Pacífico, y en el cual navegamos durante el espacio de tres meses y veinte días, sin pro- bar ni un alimento fresco... Nuestra mayor desgracia era vernos atacados de una especie de enfermedad que hacía hincharse las encías hasta el extremo de sobrepasar los dientes en ambas mandíbulas...» Año 1522. ANTONIO PIGAFETTA, Viaje alrededor del Globo, Fundación Civiltier
A. El exceso de vitaminas liposolubles como el ácido ascórbico se excreta fundamentalmente en la orina (0,5 puntos)
B. Los monosacáridos se unen mediante enlaces peptídicos para formar los triglicéridos (0,5 puntos)
C. Las aceites presentan elevados porcentajes cuantitativos de ácidos grasos insaturados (0,5 puntos)
D. Los puentes disulfuro formados entre las moléculas de fructosa mantienen la estructura terciaria de muchas proteínas. (0,5 puntos)
EBAU 1. Respecto a las enzimas:
Concepto de enzima. Indica sus características.
Factores que influyen en la actividad enzimática. Desnaturalización.
Indica cómo se nombran las enzimas (nomenclatura).
EBAU 2. Respecto a las enzimas:
-
¿Cuál es la naturaleza química de un enzima?
-
¿Qué es el centro activo de una enzima? (0,5 puntos)
-
¿Qué significa que la actividad enzimática es específica?
-
¿Cuántas enzimas quedan después de la actividad enzimática?
-
Cita dos factores físico-químico que controlan la actividad enzimática
EBAU 3. 2018 y 2019. 1. Relacionado con las enzimas:
A. Describe los conceptos de enzima y cofactor (1 punto)
B. Nombra y describe brevemente los tipos de inhibición enzimática (1 punto)
EBAU 4. Define los siguientes conceptos:
a) Enzima; b) Centro activo; c) Coenzima; d) Grupo prostético; e) Apoenzima y f) Holoenzima.
EBAU 5. 22 2. En relación con las reacciones enzimáticas:
A. ¿Qué es un biocatalizador y cuáles son los principales biocatalizadores? (1 punto)
B. Defina centro activo y describa el mecanismo de actuación de las enzimas. (1 punto)
C. Clasifica las enzimas según su función (explica brevemente cada una nombrando un ejemplo) (1 punto)
EBAU 6. 11 JUN. Conteste a las siguientes cuestiones sobre los enzimas:
a. Concepto de inhibidor enzimático.
b. Diferencie los tipos de inhibidores enzimáticos que conozcas (1,5)
EBAU 7. B) Defina vitamina y clasificación. Indique de qué moléculas forman parte, o son precursoras, la mayoría de las vitaminas hidrosolubles y mencione un ejemplo.
EBAU 8. En relación con las vitaminas como biomoléculas.
a) Cite 4 ejemplos de vitaminas indicando si son hidrosolubles o liposolubles (0,75 puntos).
b) Indique qué papel juegan las vitaminas en el metabolismo (0,5 puntos).
c) Explique por qué es necesario que los seres humanos tomemos vitaminas en la dieta y si esto le ocurre a todos los organismos. Indique si un exceso de vitaminas puede ser perjudicial para la salud y con qué tipo de vitaminas ocurriría (0,75 puntos).
COMPETENCIALES.
1. Modelos 25. En relación con las enzimas:
a) Indicar dos características fundamentales. (0,5)
b) Definir apoenzima, cofactor y coenzima. Poner un ejemplo de cofactor. (0,75)
c) Según la figura. ¿Qué enzima presenta mayor afinidad por el sustrato? Razonar la respuesta. (0,75)
3. Modelos 25. Los enzimas son moléculas catalizadoras de las reacciones químicas.
a. ¿Qué moléculas representan los números 2 y 3 del esquema? Defina sus funciones.b. ¿Qué molécula es 1 y qué proceso enzimático se representa en el esquema? Justifique su respuesta.
c. Defina centro activo de un enzima. ¿Qué fuerzas o enlaces intervienen en la unión enzima-sustrato)
- Activación de las Hidrolasas Ácidas = enzimas digestivas llamadas hidrolasas ácidas (como catepsinas, lipasas, nucleasas, etc.). Funcionan de manera óptima y eficiente solo en un entorno ácido (pH entre 4,5 y 5,5). (No requieren pH tan ácido como la pepsina ya que si se rompe el lisosoma dañaría la célula y se inactiva a pH neutro evitando también dicho daño en caso de rotura)
- .Desnaturalización de Sustratos: El pH bajo también ayuda a desnaturalizar las proteínas y otras macromoléculas que han sido englobadas en el lisosoma, haciendo que sean más accesibles y vulnerables a la acción de las hidrolasas.




























Comentarios
Publicar un comentario