UD 4. PROTEÍNAS (PRÓTIDOS)
TEMA 4. LAS PROTEÍNAS.
CONTENIDOS MÍNIMOS PARA SELECTIVIDAD ESTABLECIDOS POR LA COORDINACIÓN DE BACHILLERATO 2024-2025.
UD 4. Proteínas: características químicas, estructura y función biológica de las proteínas, analizando la importancia de su papel biocatalizador.
4.1. Proteínas. Concepto.
-
4.1.2. Aminoácidos: concepto y fórmula general.
* Propiedades de los aminoácidos: carácter anfótero y estereoisomería (D y L).
-
4.1.3. Péptidos: formación del enlace peptídico (fórmula química) y características. Polipéptidos: concepto.
-
4.1.4. Propiedades de las proteínas: conformación nativa y desnaturalización. Especificidad (de función, de especie y de individuo).
-
4.1.5. Niveles estructurales y tipos de enlaces químicos que mantienen cada nivel estructural.
-
Estructura primaria.
-
Estructura secundaria (a-hélice y estructurado de B- lámina plegada).
-
Estructura terciaria (globular y filamentosa).
-
Estructura cuaternaria.
- 4.1.6. Funciones de las proteínas, indicando los ejemplos más representativos.
ÍNDICE.
UNIDAD 4: LAS PROTEÍNAS
-
- α-hélice
- Con formación β o lámina plegada
- Hélice de colágeno
1. Introducción
2. Las proteínas
2.1. Concepto de proteína
2.2. Clasificación de las proteínas
3. Los aminoácidos
3.1. Clasificación de los aminoácidos
3.2. Propiedades de los aminoácidos: Actividad óptica Y Comportamiento químico.
3.3 Aminoácidos esenciales
4. El enlace peptídico. Características del enlace peptídico
5. Estructura de las proteínas
5.1. Estructura primaria de las proteínas
5.2. Estructura secundaria de las proteínas
5.3. Estructura terciaria de las proteínas: globulares Y fibrosas o filamentosas
5.4. Estructura cuaternaria de las proteínas
6. Propiedades de las proteínas
7. Funciones generales de las proteínas
- INTRODUCCIÓN
El término proteína fue propuesto en 1838 por el sueco J.J Berzelius para resaltar la importancia de estas moléculas. El término proviene del griego “proteios”, que significa primero o principal. Las proteínas son las moléculas orgánicas más abundantes en las células y constituyen el 50% o más de su peso seco.
Se calcula que la célula de un mamífero puede contener hasta 10.000 proteínas diferentes; sin embargo, en las plantas debido al elevado contenido de celulosa, la presencia de proteínas es mucho menor. Son polímeros formados por la unión de aminoácidos, y el orden en el que están unidos, que viene determinado por el ADN, es esencial para la función que realiza la proteína.
2. LAS PROTEÍNAS
2.1 Concepto de proteína: Son biomoléculas orgánicas, compuestas básicamente por C, H, O y N. Además, suelen contener S y, algunos tipos de proteínas, pueden presentar asociados otros elementos químicos, como P, Fe, Cu, Mg, I, etc.
Una diferencia importante entre los lípidos y las otras dos biomoléculas es que no son poliméricos.
Entre las funciones de las proteínas no figura la producción de energía, a diferencia de las otras dos.
La especificidad es una característica propia de las proteínas que no poseen lípidos ni glúcidos. Algunas de las proteínas que se encuentran en un individuo son específicas de él y no las posee ningún otro, ni siquiera aunque pertenezca a su propia especie. Sin embargo, los gemelos univitelinos tienen idénticas proteínas.
Las proteínas son polímeros de aminoácidos (aa a partir de ahora). Un aminoácido es una biomolécula orgánica, de bajo peso molecular, constituida por un C (llamado carbono α) al que hay unidos: un grupo amino (-NH2), un grupo carboxilo (-COOH), un hidrógeno (-H), y un grupo radical variable (-R). En el radical de dos aa (metionina y cisteina) aparece un átomo de azufre.
El enlace covalente que se establece entre aa se denominan enlace peptídico, y a las cadenas formadas, péptidos. Si el número de aa que forma un péptido es dos se denomina dipéptido; si es tres tripéptido, si son cuatro tetrapéptido... Si es inferior a 10 se habla de oligopéptido, y si es superior se denomina polipéptido. Sólo cuando un polipéptido se halla constituido por más de 100 moléculas de aa o si el valor de su peso molecular excede de 5.000 Da (u) se habla de proteína y forman estructuras complejas 3D funcionales.
Péptido (<10 aa); polipéptido (<100 aa); proteína (>100 aa)
2.2 Clasificación de las proteínas
Cuando una proteína está constituida exclusivamente por aa, se denomina holoproteína, y si además de aa, presenta algún otro tipo de molécula (llamada grupo prostético), recibe el nombre de heteroproteína.
|
PROTEÍNAS |
Holoproteínas |
Fibrosas o filamentosas (insolubles y estructurales) |
Colágenos, α-queratinas, β-queratinas, fibroínas, elastinas, miosinas… |
|
Globulares (esféricas y solubles) |
Albúminas, globulinas, inmunoglulinas (anticuerpos), histonas… |
||
|
Heteroproteínas (según el grupo prostético) |
Cromoproteínas (sustancia coloreada o pigmento) |
Hemoglobina, mioglobina, citocromos, hemocianina, rodopsina … |
|
|
Glucoproteínas (glúcido) (proteínas de membrana, hormonas) |
Inmunoglobulinas o anticuerpos, enzimas como la ribonucleasa, hormona estimulante del folículo (FSH), glucoproteínas del glucocálix… |
||
|
Lipoproteínas (transporta TAG, colesterol y otros lípidos) |
Lipoproteínas sanguíneas (LDL, HDL)… |
||
|
Nucleoproteínas (estructura de ácidos nucleicos) |
Nucleosomas de la cromatina, ribosomas… |
||
|
Fosfoproteínas (ácido fosfórico) |
Caseína (leche), vitelina (yema de huevo)… |
Son compuestos orgánicos que se caracterizan por poseer un grupo carboxilo (-COOH) - ácido y un grupo amino (-NH2) - básico. En los aa naturales ambos grupos se unen al mismo C; se denomina por ello C de tipo α, que es asimétrico. Las otras dos valencias del C se saturan con un átomo de hidrógeno (-H) y con un grupo variable denominado radical R. En cuanto a sus propiedades físico-químicas los aa son: sólidos, solubles en agua, cristalizables, incoloros o poco coloreados y un punto de fusión alto, mayor de 200ºC.
Existen 20 aminoácidos proteicos, que son los constituyentes básicos de las proteínas y que se diferencian por el radical R que se enlaza con el carbono α. Además, hay otros 150 que se encuentran libres o combinados en las células y en los tejidos, pero que no forman parte de las proteínas, y se conocen como aminoácidos no proteicos. Algunos de ellos son intermediarios en las reacciones metabólicas, como la citrulina o la ornitina, o forman parte de las paredes celulares de muchas bacterias.
Por sus características, los aa presentan diferentes propiedades: ACTIVIDAD ÓPTICA e ISOMERÍA.
El carbono α de todos los aa, salvo el de la glicocola o glicina (R=H), es asimétrico, ya que está enlazado a 4 radicales diferentes: un grupo amino, un grupo carboxilo, un radical R y un H. Debido a esta característica, los aa presentan actividad óptica = pueden desviar el plano de luz polarizada que atraviesa una disolución de aa.
Si un aa desvía el plano de luz polarizada hacia la derecha, se denomina dextrógiro o (+), y si lo hace hacia la izquierda, levógiro o (-).
ISOMERÍAS. La disposición L o D es independiente de la actividad óptica. Un aa tendrá una configuración D si al disponerlo en el espacio, de forma que el grupo carboxilo quede arriba, el grupo amino (-NH2) queda situado a la derecha, mientras que, si se encuentra a la izquierda, poseerá una configuración L. Por ello, un L-aa podrá ser levógiro o dextrógiro e igual ocurrirá con la configuración D. En la naturaleza la forma L es la más abundante, pues los aa proteicos son de la serie L.
La forma dipolar, en un medio ácido, capta protones y se comporta como una base (-NH3+), y en un medio básico libera protones y se comporta como un ácido (-COO-). El pH en el cual el aa tiende a adoptar una forma dipolar neutra, es decir su forma zwitterion, se denomina punto isoeléctrico.
De los 20 aa que forman parte de las proteínas, sólo algunos de ellos pueden ser sintetizados por los animales a partir de compuestos más sencillos; los restantes deben ser ingeridos en la dieta como tales. Estos últimos son los aminoácidos esenciales, que en el caso de un ser humano adulto son ocho: fenilalanina, isoleucina, leucina, lisina, metionina, treonina, triptófano y valina. En los lactantes hay que añadir la histidina. Los organismos autótrofos pueden sintetizar todos los aa que necesitan para su metabolismo.
Los alimentos fuente de aa esenciales son la carne, pescado, los huevos, el queso y otros productos de origen animal. Las personas vegetarianas deben tener en cuenta que no todos los productos de origen vegetal tienen los aa esenciales; así por ejemplo, las legumbres son deficientes en triptófano, metionina y cisteína, mientras que el arroz lo es en isoleucina y lisina. Este problema se puede solucionar con una adecuada combinación de alimentos de origen vegetal que se complementen para aportar todos los aa esenciales.
vídeo resumen
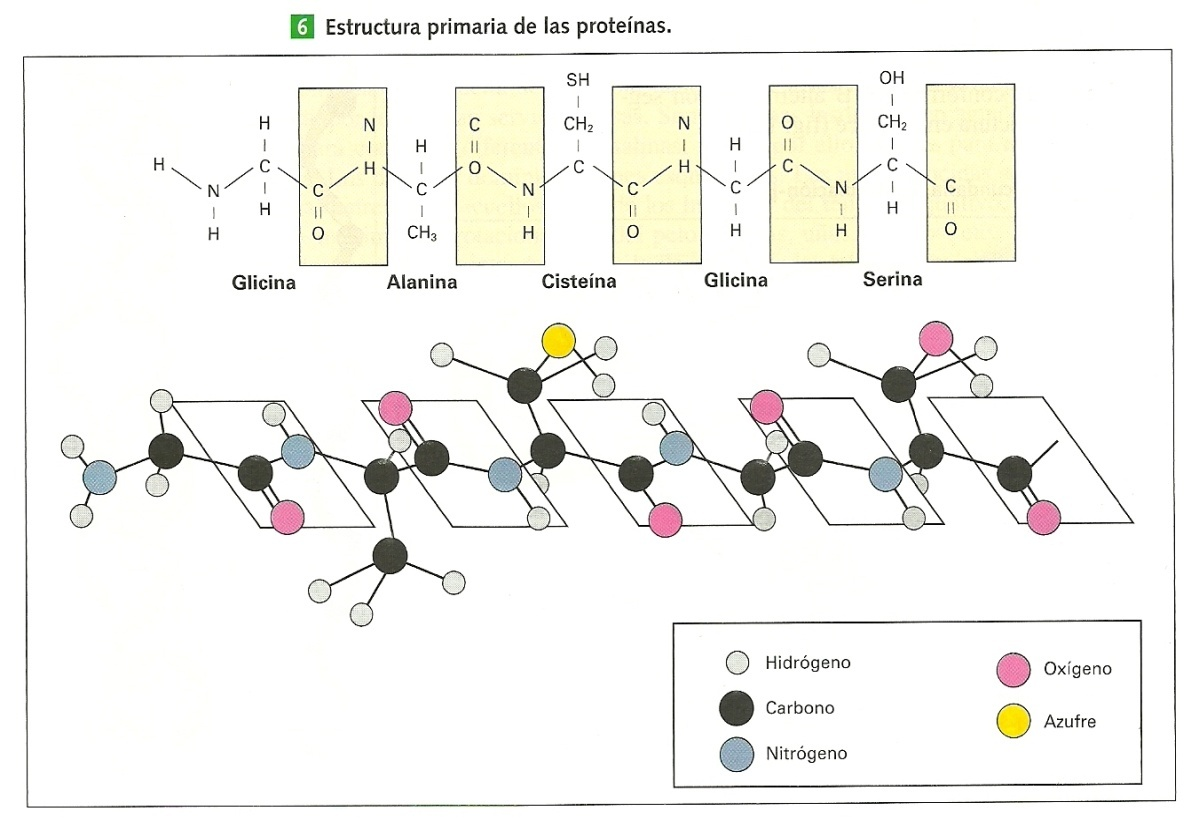
4. EL ENLACE PEPTÍDICOCuando los aa forman cadenas, lo hacen mediante enlaces peptídicos. Este tipo de uniones son covalentes entre el grupo carboxilo de un aa y el grupo amino del siguiente, liberando una molécula de agua (reacción de deshidratación o condensación). El enlace creado entre dos aa es de tipo amida (-C-N-). A su vez, este enlace puede ser hidrolizado separándose los dos aa. En el enlace peptídico no participan los radicales de los aa, que quedan “colgando” del polipéptido, hacia arriba y hacia abajo alternativamente.
Los aa unidos por enlaces peptídicos se denominan residuos para resaltar la pérdida de átomos en la formación del enlace peptídico. Un dipéptido es una cadena de 2 residuos de aa, un tripéptido está formado por 3, un oligopéptido contiene menos de 50 residuos, y, se denomina polipéptidos a las cadenas más largas.
Los grupos amino y carboxilo libres en los extremos opuestos de la cadena polipeptídica se nombran como extremos: N-terminal (amino inicial) y C-terminal (carboxilo terminal). Por convenio, los residuos se numeran desde el aa N-terminal, y se escriben de izquierda a derecha en el orden que ocupan en la cadena.
4.1. Características del enlace peptídico
La estructura precisa del enlace peptídico fue descubierta en la década de 1950 por L. Pauling y R.B. Corey utilizando técnicas de difracción de rayos X. Descubrieron que este enlace presenta unas características especiales de gran importancia para la estructura de las proteínas:
-
El enlace peptídico es un enlace covalente más corto que la mayor parte de los demás enlaces C-N.
-
Posee cierto carácter de doble enlace, lo que le impide girar libremente.
-
Los cuatro átomos del grupo carboxilo y del grupo amino, que intervienen en el enlace peptídico, se hallan situados sobre un mismo plano, manteniendo distancias y ángulos fijos.
-
Los únicos enlaces que pueden girar, y no del todo libremente, son los formados por Cα-C y N-Cα.
La importancia biológica del enlace peptídico se centra en su papel primordial en la formación de la estructura primaria de las proteínas. Sin enlace peptídico no podrían existir las proteínas.
5. ESTRUCTURA DE LAS PROTEÍNAS
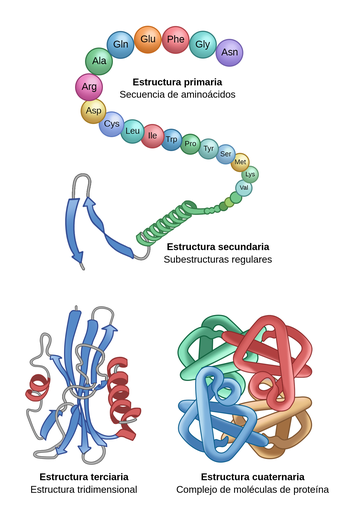
La organización de una proteína viene definida por cuatro niveles estructurales, desde el más sencillo al más complejo: estructura primaria, secundaria, terciaria y cuaternaria. Cada una de estas estructuras nos informa de la disposición de las estructuras anteriores en el espacio.
5.1. ESTRUCTURA PRIMARIA (E1ª) DE LAS PROTEÍNAS
Se corresponde a la secuencia de aa de la proteína. Por tanto, nos indica qué aa componen la cadena polipeptídica y el orden en que dichos aa se disponen en la cadena. Es la más sencilla y, sin embargo, la más importante, ya que determina el resto de las estructuras proteicas con niveles superiores de organización. La función de una proteína depende de su secuencia de aa y de la forma que ésta adopte.
Todas las proteínas presentan un extremo N-inicial o terminal, en el que se encuentra el primer aa con su grupo amino libre, y un extremo C-terminal, en el que está situado el último aa con su grupo carboxilo libre. Por convenio, los aa de la cadena se numeran comenzando por el que posee el extremo amino libre, que se sitúa a la izquierda.
Una característica de la E1ª es su disposición en zigzag. Se debe a la planaridad del enlace peptídico que provoca la rotación de los aa sobre los Cα para equilibrar las fuerzas de atracción que se pudieran generar.
Con los veinte aa proteicos, el número de polipéptidos que pueden formarse es de 20n, donde n es el número de aminoácidos presentes en la cadena. Como la mayoría de los péptidos contienen más de cien aa, incluso miles, la variedad de posibles secuencias es prácticamente ilimitada.
5.2 ESTRUCTURA SECUNDARIA (E2ª) DE LAS PROTEÍNAS
Es la disposición de la cadena de aa (E1ª) en el espacio. A medida que los aa se van uniendo durante la síntesis proteica, y gracias a la capacidad de giro de los enlaces no peptídicos (en torno a los Cα), la cadena polipeptídica que se forma adopta una disposición espacial estable que corresponde a la E2ª.
El tipo de E2ª que presenta una cadena polipeptídica depende del número de enlaces o puentes de hidrógeno que se puedan formar, es decir, de los aa que la constituyen (sus R). También depende de las condiciones de tensión y de temperatura en que se encuentra.
Los modelos más frecuentes son: α-hélice y conformación β o lámina plegada. Una variedad de E2ª es la denominada hélice de colágeno, característica del colágeno.
-
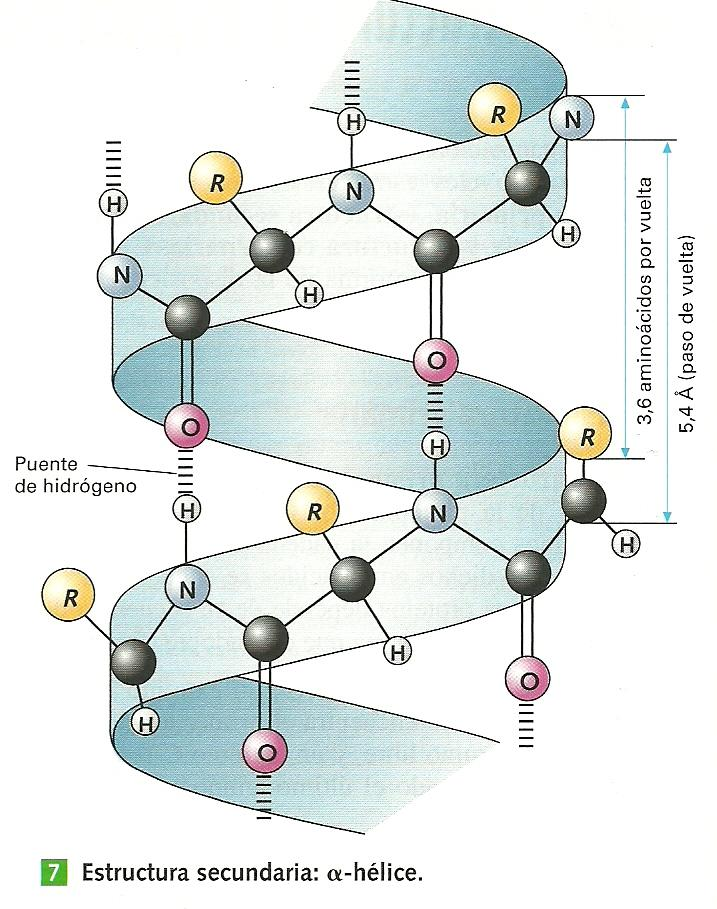
α-hélice
La E2ª en α-hélice se forma al enrollarse la E1ª helicoidalmente sobre sí misma, con un giro dextrógiro (la rotación se produce hacia la derecha, de forma que cada aa gira 100º con respecto al anterior).
La cadena polipeptídica se va enrollando en espiral sobre sí misma debido:
-
A los giros que se producen en torno al Cα de cada aa,
-
A la formación espontánea de enlaces de H entre el oxígeno del –CO- de un aminoácido y el H del –NH- del cuarto aa siguiente y
-
A la interacción de los radicales hidrófilos en la disolución en la que se encuentran.
La formación espontánea de los enlaces de H hace que todos los oxígenos de los grupos –CO- queden orientados en el mismo sentido, mientras que todos los hidrógenos de los grupos –NH- queden orientados en sentido contrario. Los radicales de los aa quedan dirigidos hacia el exterior de la α-hélice. Debido a la falta de participación de los grupos R proteínas con E1ª muy diferentes pueden adoptar la misma E2ª. Se forma así una hélice que presenta 3,6 de restos de aa por vuelta. La α-queratina (fabricada por células epidérmicas-piel), presente en uñas, pelo, plumas, escamas, etc. es una proteína que presenta este tipo de E2ª.
Esta estructura α-hélice se mantiene estable gracias a los puentes de H intracatenarios formados entre el grupo –NH de un enlace peptídico y el grupo C=O del cuarto aa que lo sigue. La formación de estos enlaces determina no solo la estabilidad de la E2ª, sino también la longitud del paso de rosca, es decir, el avance por vuelta =0,54 nm.
Competencial ¿Por qué crees que la abundancia del aminoácido prolina en una cadena polipeptídica impide la estabilización de la α -hélice?
En el aminoácido prolina el grupo amino forma parte de un ciclo; es decir, es una amina secundaria
y el nitrógeno lleva unido un solo átomo de hidrógeno.
Este se pierde cuando se forma el enlace peptídico y, por tanto, no queda ninguno libre para crear los enlaces de hidrógeno que estabilizan la estructura secundaria. Por consiguiente, la abundancia del aminoácido prolina en una cadena polipeptídica dificulta la formación de α-hélices y de láminas plegadas. De hecho, las proteínas con mucha prolina (como el colágeno) tienen una estructura particular característica, distinta de ambas.
-
Conformación β o lámina plegada
En la conformación β la cadena polipeptídica forma una cadena distendida en forma zigzag debido a:
-
La ausencia de enlaces de H entre los aa próximos,
-
Que algunas proteínas conservan su E1ª en zigzag (debido a la rigidez del enlace peptídico) y
-
La apolaridad de los grupos R de los aa que componen la proteína.
Si la cadena con conformación β se repliega sobre sí misma se pueden establecer enlaces de H intracatenarios entre segmentos, antes distantes, que debido al replegamiento quedan próximos. Esta disposición puede dar lugar a una lámina en zigzag muy estable, denominada β-lámina plegada. Esta estructura en lámina plegada también se puede formar entre dos o más cadenas polipeptídicas diferentes que se asocian mediante enlaces de H intercatenarios. Las cadenas laterales de los aa (grupos R) se disponen de forma alternativa por encima y por debajo de esta estructura. La fibroína de la seda y la β- queratina, presente en la tela de araña, tienen esta conformación β.
-
Hélice de colágeno
El colágeno posee una disposición en hélice especial, algo más alargada que la α-hélice, debido a la abundancia de prolina e hidroxiprolina. Estos aa presentan una estructura que dificulta mucho la formación de puentes de H, por lo que no se forma una α-hélice sino una hélice más extendida, que sólo presenta 3 aa por vuelta.
La estabilidad de la hélice de colágeno se debe a la asociación de tres hélices, que originan una superhélice o molécula completa de colágeno. Las tres hélices se unen mediante enlaces covalentes y enlaces débiles de tipo puente de H, por lo que se trata de una estructura particularmente rígida. De esta forma la encontramos en el tejido conjuntivo de los tendones.
Informa sobre la disposición espacial de la E2ª de un polipéptido al plegarse sobre sí misma originando una conformación que puede ser fibrosa o globular. Es la E1ª la que determina la E2ª y E3ª.
Proteínas globulares o esferoproteínas
La conformación globular en las proteínas facilita su solubilidad en el agua y en disoluciones salinas, pues los R apolares se sitúan en el interior y los polares en el exterior. Esto les permite realizar funciones de transporte, enzimáticas, hormonales, etc.
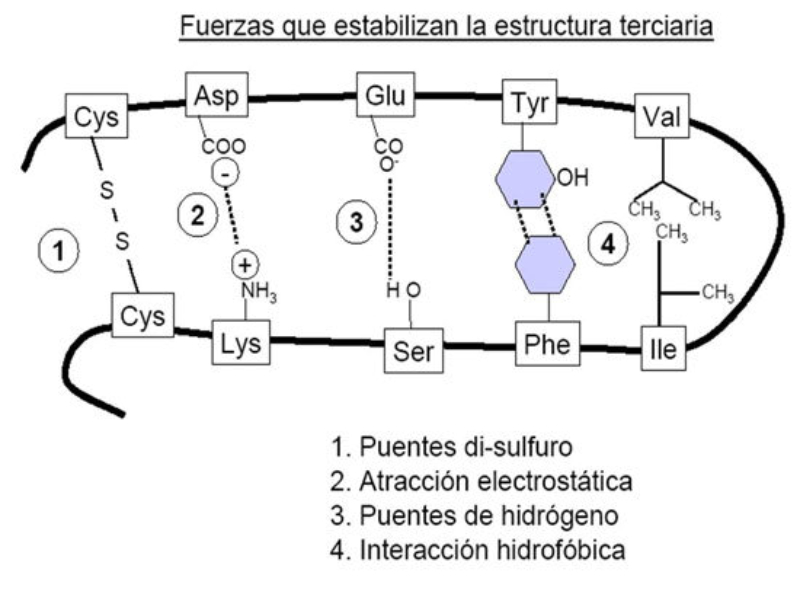
Las conformaciones globulares se mantienen estables por la existencia de enlaces entre los radicales R de los aa. Aparecen varios tipos de enlaces: enlaces covalentes fuertes, como los enlaces o puentes disulfuro, que se dan entre dos restos de azufre (cisteína) y otros débiles, pero más frecuentes, como los puentes de H (entre R polares), las fuerzas de Van der Waals e interacciones hidrofóbicas (entre R apolares) y las interacciones iónicas (entre R cargados positiva y negativamente)
Generalmente, las proteínas globulares en los tramos rectos la cadena polipeptídica posee E2ª de tipo α-hélice o lámina β, y en los codos o “giros” presenta secuencias sin una estructura precisa.
Se ha observado que existen combinaciones de α-hélice y conformación β que aparecen repetidamente en proteínas distintas. Estas combinaciones suelen ser estables, compactas y de aspecto globular y reciben el nombre de dominios estructurales.
Desde una perspectiva evolutiva, se considera que los dominios estructurales presentan una elevada eficacia biológica, por lo que han servido como unidades modulares para constituir diferentes tipos de proteínas globulares. Los distintos dominios suelen estar unidos por zonas estrechas o “cuellos”, lo que posibilita un cierto movimiento rotacional. Así, al separarse dos dominios, permiten la introducción de la molécula de sustrato y, al acercarse, la fijan para actuar sobre ella.
Las proteínas globulares presentan un mayor plegamiento que las proteínas filamentosas o fibrosas. Las proteínas globulares van a desarrollar diversas funciones, transportadora (hemoglobina), enzimática, etc.
Proteínas fibrosas o filamentosas o escleroproteínas
Las proteínas filamentosas o fibrosas que no llegan a formar E3ª globulares mantienen su E2ª alargada. Son proteínas insolubles en agua y disoluciones salinas, siendo por ello idóneas para realizar funciones estructurales y esqueléticas. Las más conocidas son el colágeno de los huesos y del tejido conjuntivo, la fibroína del hilo de seda y de las telarañas, y la elastina del tejido conjuntivo, que forma una red deformable por la tensión.
Las proteínas fibrosas o filamentosas están poco plegadas a diferencia de las proteínas globulares, y al igual que en éstas se establecen puentes disulfuros, puentes de H, fuerzas de Van der Waals, interacciones iónicas e hidrofóbicas.
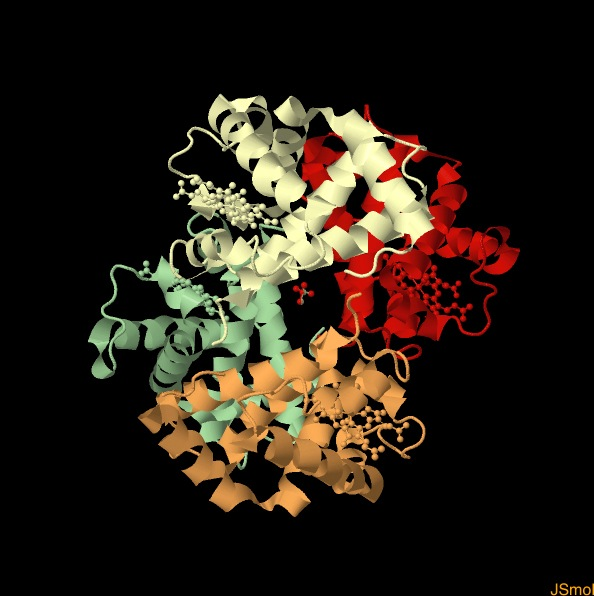
5.4 ESTRUCTURA CUATERNARIA (Eª4) DE LAS PROTEÍNAS
Es la que presentan las proteínas constituidas por dos o más cadenas polipeptídicas con E3ª, idénticas o no, unidas entre sí por enlaces débiles (no covalentes) y, en ocasiones, por enlaces covalentes del tipo enlace disulfuro. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero.
Según el número de protómeros que se asocian, las proteínas que tienen E4ª se denominan dímeros, como la insulina; trímeros, como el colágeno, tetrámeros, como la hemoglobina; pentámeros, como la ARN-polimerasa; y polímeros, cuando en su composición intervienen un gran número de protómeros. Son ejemplos de polímeros la cápsida del virus de la poliomielitis, que consta de 60 subunidades proteicas, los filamentos de actina y miosina de las células musculares, etc.
6. PROPIEDADES DE LAS PROTEÍNAS
Sus propiedades; solubilidad, desnaturalización y especificidad, dependen básicamente de la naturaleza de los radicales (-R) de los aa y de la capacidad que estos tienen de reaccionar con otras moléculas.
-
Solubilidad. La solubilidad de las proteínas en agua se debe a que solo los grupos –R polares o hidrófilos se hallan localizados sobre la superficie externa de la proteína, y a que se establecen puentes de H con el agua; así, la proteína se rodea de una capa de agua =CAPA DE SOLVATACIÓN que impide su unión con otras proteínas, lo que provocaría su precipitación. En general, las proteínas fibrosas son insolubles en agua, mientras que las globulares son hidrosolubles. (así es en lípidos)
-
Desnaturalización. Consiste en la rotura de los enlaces que mantienen el estado nativo (CONFORMACIÓN NATIVA = estructura 3D más estable de la proteína plegada que determina su funcionalidad – E3ª principalmente) de la molécula, perdiéndose la E2ª, 3ª y 4ª (se rompen enlaces intramoleculares). Sin embargo, los enlaces peptídicos permanecen, así la proteína conserva su E1ª y pasa a adoptar una forma filamentosa.
La desnaturalización puede estar provocada por cambios en el pH, en la temperatura o concentración salina, o bien por el tratamiento con sustancias desnaturalizantes, como la urea. Al perder sus E2ª, 3ª y 4ª, las proteínas desnaturalizadas también pierden su actividad biológica. Además, la proteína desnaturalizada suele precipitar, ya que las atracciones entre los grupos hidrofóbicos, que en la proteína nativa estarían encerrados en el interior de la molécula, los hacen agruparse entre sí.
En determinadas condiciones, la desnaturalización puede ser reversible: las proteínas pueden renaturalizarse, replegarse y adoptar nuevamente su conformación nativa, recuperando con ello la actividad biológica perdida.
- Sólo habrá renaturalización si aquello que lo provoca es poco intenso y duradero.
- Que sea reversible te debe hacer ver y entender que la Eª 3D funcional de una proteína/enzima no es más que la conformación espacial más estable - ello, obviamente, depende de la secuencia de aa y del medio en el que se encuentra.
- El calor provoca desnaturalización pero sólo rompe enlaces débiles como pdH, pero no covalentes como los pS-S (urea o agentes químicos reductores)
Algunos ejemplos de desnaturalización de la vida cotidiana son cuando se corta la leche por la desnaturalización de la caseína, la precipitación de la clara de huevo al desnaturalizarse la ovoalbúmina por efecto del calor, la “permanente” o fijación de un peinado del cabello por efecto del calor sobre las queratinas del pelo, etcétera. (rizar el pelo de forma permanente = químicos reductores que rompen termporalmente los pSS de los aa de cisteína de la queratina - después se enrolla el pelo en un tubo y se añaden químicos oxidantes como el peróxido de hidrógeno para volver a formar los pSS)
Ejemplo competencial. Cuando se fríe o se cuece un huevo la clara cambia su aspecto y consistencia.
a) Propón una explicación razonada para dichos cambios. ¿Este proceso es reversible o irreversible?
b) Explica por qué se desencadenan cambios semejantes con unas gotas de ácido clorhídrico.
El HCl crea un ambiente muy ácido en el estómago, con un pH que puede oscilar entre \(1,5\) y \(2,5\). Esta alta acidez rompe las interacciones débiles (como los puentes de hidrógeno y las interacciones iónicas) que mantienen la estructura tridimensional de la proteína.
Ejemplo competencial. Al lavar una prenda de lana con agua caliente, encoge. Sin embargo, esto no ocurre con las prendas de seda. ¿Por qué?
- La lana es pelo de algunos animales y está constituida por la proteína α-queratina y, por ello, presenta una estructura secundaria en α-hélice.
- La proteína de la seda (fibroína) contiene gran cantidad de aminoácidos glicina, alanina y serina (Grupos R pequeños) y presenta una estructura secundaria en Beta - lámina plegada.
- Al aplicar calor existe un grado de alteración mayor en la α-hélice que en la lámina plegada, por ello el acortamiento en el caso de la lana es mayor.
-
Especificidad. Las proteínas tienen unos aa concretos en lugares determinados y, además, presentan una estructura 3D específica que les permite diferenciar unas moléculas de otras parecidas y llevar a cabo una función determinada. Esta especificidad de función es necesaria en los casos de las proteínas que interactúan con otras moléculas, como son las proteínas enzimáticas, que actúan como reguladoras de las reacciones bioquímicas, las hormonas proteicas como la insulina y los anticuerpos o inmunoglobulinas.
Las proteínas homólogas, las que realizan la misma función en especies diferentes, presentan una estructura muy similar, pero no siempre idéntica. Esto se debe a que pueden diferir en aquellos aa susceptibles de ser sustituidos por otros distintos sin que se altere su funcionalidad (-R con mismas propiedades químicas). Esto ha dado lugar, durante el proceso evolutivo, a una gran variedad de proteínas, es decir a proteínas específicas de una especie (Especificidad de especie) e, incluso, de un individuo (Especificidad de individuo) , lo que provoca problemas de rechazo en los trasplantes de órganos. Por otra parte, las diferencias entre proteínas homólogas son grandes entre especies alejadas evolutivamente, y escasas entre especies muy emparentadas.
La comparación de la secuencia aminoacídica de un mismo tipo de proteína en diferentes especies se emplea para establecer el grado de parentesco evolutivo entre ellas. La actividad propuesta permite deducir que el gorila está más directamente emparentado con el ser humano que las otras especies, pues solo se diferencia en un aminoácido. La especie más alejada evolutivamente, según esta comparación, es el caballo.
-
Homeostática. Capacidad amortiguadora del pH - tampón. Las proteínas tienen un comportamiento anfótero, al igual que los aa que las forman. Debido a que pueden comportarse como ácidos o bases, liberando o retirando H+ del medio, las proteínas son capaces de amortiguar las variaciones de pH del medio en el que se encuentra.
7. FUNCIONES GENERALES DE LAS PROTEÍNAS con ej más representativos
Las proteínas son moléculas de una gran diversidad estructural, lo que les confiere la capacidad de intervenir en muchas y muy diversas funciones, pudiendo una misma proteína realizar más de una función.
-
Función de reserva. Las proteínas son reservorios de aa, que pueden ser utilizados como elementos nutritivos necesarios para el desarrollo embrionario, como ocurre en el caso de la ovoalbúmina de la clara de huevo, albumina en plasma sanguíneo, o la caseína de la leche, el gluten de la semilla de trigo, etc.
-
Función de transporte. Hay proteínas que se unen a diversas sustancias y las transportan a través de un medio acuoso, ej es el oxígeno o los lípidos. Algunas proteínas transportadoras son: las lipoproteínas que transportan lípidos en el plasma sanguíneo (ej la LDL que puede transportar 1500 moléculas de ésteres de colestorel, 500 de colesterol libre, 800 de fosfolípidos y 450 de TAG), la hemoglobina y la hemocianina pigmentos respiratorios que transportan oxígeno o la seroalbúmina que transporta un gran número de sustancias (ácidos grasos). Citocromos, proteínas transportadoras de electrones en la membrana celular de las bacterias y en la membrana interior de las mitocondrias y de los cloroplastos en la respiración celular y en la fotosíntesis.
-
Función contráctil. Gracias a esta función de contracción es posible la movilidad. La flagelina, que forma parte del flagelo bacteriano, permite la movilidad de las bacterias. La actina y la miosina al moverse entre sí llevan a cabo la contracción y relajación muscular y posibilitan el movimiento del músculo.
-
Función defensiva. Esta función defensiva la realizan las gammaglobulinas o inmunoglobulinas que constituyen los anticuerpos, que son capaces de discriminar lo propio de lo ajeno, y por lo tanto, defienden a los seres vivos contra las infecciones provocadas por organismos patógenos. Los anticuerpos se asocian a los antígenos, determinadas sustancias extrañas que penetran en el organismo, y los neutralizan.
-
Función hormonal. Transportan mensajes químicos. Algunas proteínas actúan como hormonas, son proteínas reguladoras que en pequeñas concentraciones son capaces de controlar importantes funciones celulares, como el metabolismo o la reproducción. De esta forma la insulina y el glucagón proteínas secretadas por el páncreas, regulan la cantidad de glucosa en sangre; la hormona del crecimiento o somatotropina (GH) regula el crecimiento corporal.
-
Función estructural. Las proteínas, sobre todo las fibrosas, realizan importantes funciones estructurales, proporcionando soporte mecánico a las células animales y vegetales. Se pueden encontrar tanto en las células como en los tejidos. Ejemplos de proteínas con función estructural a nivel celular son las glucoproteínas de la membrana plasmática, las histonas de los cromosomas y la tubulina que forma parte de los microtúbulos que constituyen los cilios y flagelos; a nivel histológico, destacan el colágeno en los tejidos conjuntivos, la queratina en la epidermis o la elastina en el cartílago.
-
Función enzimática. (UD5 - tema siguiente) Los catalizadores bioquímicos –conocidos como enzimas- son proteínas que catalizan la práctica totalidad de las reacciones químicas del metabolismo que tiene lugar en las células vivas, aumentando la velocidad de dichas reacciones. Se conocen numerosas enzimas y se clasifican según la reacción que catalizan. Algunas enzimas son la maltasa, presente en el intestino delgado, que convierte la maltosa en dos glucosas y la lipasa, enzima intestinal, que disgrega las grasas de los alimentos para facilitar su absorción.

-
Función homeostática. Esta función consiste en mantener constante los valores de determinadas variables del medio interno, como son la salinidad, la acidez o la concentración de glucosa. Un ej de ello son las proteínas sanguíneas que participan en la regulación del pH gracias a su capacidad amortiguadora (sistema tampón o buffer – ver animación punto isoeléctrico aa) y la trombina y el fibrinógeno, que participan en la coagulación de la sangre cuando se produce la rotura de un vaso sanguíneo = Función de defensa.
-
Función de reconocimiento de señales químicas. Situadas en la superficie exterior de las membranas celulares, existen numerosas proteínas encargadas del reconocimiento de señales químicas. Las hay capaces de reconocer hormonas, neurotransmisores, anticuerpos, virus, bacterias.
-
Transducción de señales. En biología celular, se entiende por transducción el proceso por el que una célula produce una respuesta a una señal extracelular. Estos procesos están mediados por proteínas; así por ejemplo, la rodopsina de la retina convierte una señal luminosa en un impulso nervioso.
ANEXO. Diferencias y semejanzas entre la estructura secundaria en α- hélice y en lámina plegada. Completar tabla.
|
|
α- hélice |
Conformación β o lámina plegada |
|
Semejanzas |
Ambos modelos son dos tipos básicos de estructura secundaria de una proteína, es decir, de la disposición de la secuencia de aminoácidos o estructura primaria de una proteína en el espacio. En una proteína determinada pueden coexistir ambos tipos, aunque una de ellas puede predominar sobre la otra, ello dependerá de los aminoácidos que la formen |
|
|
Diferencias |
La cadena polipeptídica se enrolla en espiral sobre sí misma, siguiendo el sentido de giro de las agujas del reloj. Hélice dextrógira.
Las cadenas laterales de los aminoácidos aparecen proyectadas hacia la parte externa de la hélice.
Esta estructura se mantiene estable mediante enlaces de H intracatenarios. |
Se produce un plegamiento en forma de fuelle o lámina plegada en zigzag, originando un acoplamiento de segmentos de la misma cadena o de distinta.
Las cadenas laterales de los aminoácidos se disponen alternativamente por encima y por debajo.
La estructura se mantiene estable por medio de enlaces de H intra e intercatenarios. |
EJERCICIO PAU 2025.
PAU 25. RIOJA.1.- Las proteínas son moléculas que podemos denominar como "organizadas", es decir tienen una estructura característica, específica y ordenada.
a) Explique las estructuras que pueden tener las proteínas que las hacen estar "organizadas" (0,8p)
b) ¿Qué relación existe entre estas estructuras y su función específica? (0,2 puntos)
PAU 25. ANDALUCÍA. En un estudio bioquímico se llevó a cabo la hidrólisis total de una toxina bacteriana de
naturaleza proteica (muestra A) y una enzima de ratón que no tiene ningún efecto tóxico (muestra B),
y se determinó que la composición de aminoácidos era exactamente igual en ambas.
a) Sabiendo que las proteínas de los seres vivos están constituidas por los mismos 20 aminoácidos, responda razonadamente cómo se puede explicar que la proteína de la muestra A sea tóxica y la proteína de la muestra B no lo sea [0,5].
b) Indique qué elementos y/o grupos químicos son comunes en la composición química de los 20 aminoácidos y cuales son diferentes [0,5].
c) Explique cómo puede afectar la temperatura a la actividad de una enzima [0,4].
d) Indique la composición química de los ribosomas y cuatro localizaciones de una célula eucariota donde se pueden encontrar realizando su función [0,6].
PAU 25. VALENCIA. 2.2.
a) En la siguiente imagen se muestra la estructura de una biomolécula. Indique a qué grupo de biomoléculas
pertenece y cómo se llama su unidad estructural (monómero).
¿Cuántos monómeros se observan en la biomolécula?
¿Qué enlace se forma entre los monómeros? Explique las características de este tipo de enlace (1,5 puntos).
b) Indique las estructuras celulares donde se pueden encontrar la actina y la tubulina. ¿Qué función tienen estas
estructuras? (1 punto).
PAU 25. CANARIAS.En el folleto divulgativo se informa “La alergia a la leche (más concretamente, a sus componentes como la caseína,
la β-lactoglobulina …) no es lo mismo que la intolerancia a la lactosa, debida a que las persona tienen una ausencia
o bajo nivel de la lactasa”. (Fuente: Agencia Española de Seguridad Alimentaria y Nutrición, AESAN).
a. Indica las unidades estructurales de cada una de las biomoléculas del texto (negrita).
b. Indica el nombre del enlace de unión de las citadas unidades básicas.
c. Dibuja la estructura básica y común de las unidades que constituyen a la lactasa.
d. Indica cuál es la composición de un heterósido.
PAU 25. CANARIAS.El uso de insectos como fuente de proteínas representa una forma de enfrentar los crecientes desafíos del
suministro de proteínas y el desperdicio de alimentos. Los insectos son una fuente sostenible de proteínas y
el proceso de crianza necesita recursos mínimos en comparación con la ganadería tradicional
a. Define las estructuras secundaria, terciaria y cuaternaria de las proteínas.
b. Cita 2 ejemplos de proteínas globulares.
c. Define el proceso de desnaturalización.
d. Cita 2 factores que causan este proceso.
PAU 25. CANARIAS. El Premio Nobel de Química 2024 reconoce la gran aportación al campo de biología
molecular. La mitad del premio ha sido para David Baker, por el diseño computacional que permite construir
tipos completamente nuevos de proteínas. La otra mitad para Demis Hassabis y John Jumper que desarrollaron
'AlphaFold', un modelo de IA capaz de predecir la forma exacta de las proteínas a partir de su secuencia genética.
(Fuente: Nobelprize.org).
a. Indica los niveles de estructuración en las proteínas. b. Cita los tipos de estructura terciaria de las proteínas.
c. Define los conceptos de: holoproteínas y heteroproteínas.
d. Define grupo prostético.
PAU 25.Zaragoza. Elija únicamente una de las dos opciones que se plantean:
Opción 3.A) Un equipo de científicos analizó muestras del asteroide Ryugu, recogidas a 15
millones de kilómetros de la Tierra, y encontró moléculas que podrían haber contribuido al
origen de la vida. (2 puntos)
a) Identifique las moléculas 1 y 2 de la imagen. Sea lo más concreto posible. (0,2 puntos)
b) Respecto a la molécula 1, ¿cuáles son sus unidades estructurales? ¿cómo se llama el
enlace entre dichas estructuras? (0,4 puntos)
c) Respecto a la molécula 2, ¿de qué macromolécula es monómero y qué enlace une esos
monómeros tipo 2? (0,4 puntos)
d) Describa los diferentes niveles estructurales de la macromolécula formada por la unión
de varios monómeros tipo 2, así como el tipo de enlaces que se forman para la
estabilización de dichas estructuras. ¿En qué orgánulo celular se añaden moléculas 1
a las macromoléculas formadas por las moléculas 2? (1 punto)
PAU 25. ASTURIAS. Pregunta 1. El esquema adjunto representa una proteína asociada a una molécula de ADN. El recuadro 1 es una ampliación de una zona de la proteína y el recuadro 2 es una ampliación de la molécula de ADN.
Opción A
1. Indica cuál es la unidad fundamental de las proteínas, qué enlace establecen explicando los grupos químicos implicados e identifica los átomos señalados con las letras A, B, C y D. (Calificación 1 punto)
2. Indica los nombres de los dos tipos principales de conformaciones de la estructura secundaria de una proteína, señalando los tipos de enlace que mantienen estable dicha estructura y los grupos químicos entre los que se establecen estos enlaces. (Calificación 1 punto)
3. Señala a qué nivel estructural de la proteína que se representa afectaría un cambio que produjera la separación de las dos cadenas peptídicas y explica qué efecto tendría. (Calificación 0.5 puntos)
Opción B
1. Indica cuál es la unidad fundamental del ADN, cuántas de estas unidades se representan en el esquema y a qué corresponden las letras A, B y las parejas C-C´y D-D´. (Calificación 1 punto)
2. Señala los nombres de los enlaces señalados con los números 1, 2 y 3 y explica que le pasa al ADN cuando se rompen los enlaces señalados con el número 3. (Calificación 1 punto)
3. Indica qué representa el componente señalado con el número 4 y explica por qué es importante esta zona de la macromolécula. (Calificación 0.5 puntos)
PAU 25. ARAGÓN..Opción 2.B) Existen una serie de “tiritas” o apósitos que contienen en su interior larvas de la mosca Lucilia sericata. Se utilizan para tratar heridas que no responden a otros tratamientos tradicionales. Estas larvas secretan una serie de enzimas que digieren el tejido muerto de la herida. Responda las siguientes preguntas (2 puntos):
a) ¿Qué es una enzima y qué función cumple en las reacciones químicas? Explíquelo brevemente. (0,6 p)
b) Una de las enzimas secretadas es una peptidasa, que rompe los enlaces entre los monómeros de las proteínas, ¿cómo se llaman dichos monómeros? ¿cómo se llaman dichos enlaces? (0,4 puntos)
c) Razone que ocurrirá con la actividad de las enzimas secretadas por las larvas en cada una de estas situaciones: i) si dejamos una de estas “tiritas” en un frigorífico, ii) cuando se aplican a temperatura ambiente, iii) si sometemos una de esas tiritas a una temperatura extremadamente elevada. (0,6 puntos)
d) Algunas bacterias presentes en heridas infectadas producen inhibidores enzimáticos. ¿Cómo afectaría esto a la efectividad de la terapia? (0,4 puntos)
PAU 25. CASTILLA LEÓN. Pregunta 1. Competencial (Obligatoria) (2 puntos)
El descubrimiento de la insulina en 1921 supuso un antes y un después para las personas con diabetes. Fue en 1922, cuando se administró por primera vez insulina a un joven diabético, quien recibió una inyección de extracto de páncreas purificado. En ese momento la insulina se obtenía de animales como perros, vacas o cerdos, sobre todo de estos últimos, porque la insulina de cerdo era muy similar a la humana, aunque contenía algunas impurezas. Sin embargo, actualmente la técnica utilizada es la producción de insulina por medio de bacterias modificadas genéticamente.
a) ¿Qué tipo de biomolécula es la insulina? ¿Cuáles son sus unidades estructurales y qué tipo de enlace las mantiene unidas? (0,6)
b) Mencionar dos ventajas de la producción actual de insulina en comparación con los métodos iniciales. (0,5)
c) Describir brevemente otra aplicación médica de las técnicas de modificación genética. (0,5)
d) Indicar cuatro aplicaciones de la biotecnología en áreas distintas a la medicina. (0,4)
PAU 25. CASTILLA LEÓN.Opción 2.B. Dados los siguientes aminoácidos:
a) Escribir la fórmula del dipéptido que formarían. (0,5)
b) ¿Presentan estos aminoácidos carbonos asimétricos? Razonar la respuesta. (0,5)
c) ¿Qué tipos de enlaces intervienen en la estabilización de cada uno de los niveles estructurales de las proteínas?
PAU 25. CATALUÑA .PREGUNTA 1 (2,5 puntos).
Nobel de Química 2024 a David Baker, Demis Hassabis y John Jumper por revelar los secretos de las proteínas con IA y computación La Real Academia de las Ciencias de Suecia ha otorgado este miércoles el Premio Nobel de Química 2024, con una mitad a David Baker por “el diseño de proteínas con computación” y la otra mitad conjuntamente a Demis Hassabis y John Jumper por “la predicción de la estructura de las proteínas mediante el uso de inteligencia artificial”. El comité que ha otorgado el galardón ha destacado las potenciales aplicaciones de sus logros científicos en numerosos procesos
en los que están implicadas las proteínas, desde el desarrollo más rápido de vacunas al descubrimiento de nuevos nanomateriales, pasando por el diseño de fármacos dirigidos a tratar el cáncer o la evolución hacia una industria química más verde.
El País, 9 de octubre de 2024, Francisco Doménech.
a) Explique brevemente los diferentes niveles de complejidad estructural que se pueden diferenciar en una proteína.
¿A cuál/es de ellos haría referencia el texto? Razone su respuesta (1,25 puntos).
b) Según esta noticia, la predicción de la estructura tridimensional de las proteínas supone un gran avance para estudios relacionados con la biomedicina. ¿Por qué es importante conocer la estructura de las proteínas? Justifique su respuesta (0,5 puntos).
c) Una de las aplicaciones que se citan en el texto es el diseño de fármacos que podrían alterar la actividad enzimática de una proteína. ¿Qué zona de una enzima sería interesante analizar para poder diseñar una molécula que alterase su actividad? ¿Por qué? Indique un efecto que podría tener dicho fármaco sobre la reacción enzimática (0,75 puntos).
PAU 25. NAVARRA. biomoléculas
1. a) Nombra el tipo de biomolécula a la que pertenecen: i) los ácidos grasos, ii) los aminoácidos, iii) los nucleótidos. (0.25 P) b) Indica una molécula compleja de cada uno de estos grupos e indica el principal tipo de enlace que utiliza. (0.5 P) c) ¿Qué tipo de biomoléculas están presentes mayormente en los siguientes alimentos: lechuga, filete de ternera, harina de trigo y mantequilla? (0.25 P)
2. TEBRIO es una empresa líder a nivel mundial que utiliza la quitina para aplicaciones bio-industriales, como la fabricación de plásticos biodegradables. a) ¿A qué grupo de biomoléculas pertenece la quitina y en qué seres vivos podemos encontrarla? (0.75 P) b) La quitina se mezcla con otros polímeros naturales como la celulosa para mejorar flexibilidad y resistencia: ¿Qué diferencias estructurales tiene la quitina respecto a la celulosa? (0.25 P)
EJERCICIOS EBAU
C. Considerando que se trata de una proteína natural, razone si los aminoácidos presentes en la molécula son D o L. (0,5 puntos).
D. Si molécula está formada por 10 aminoácidos, ¿Cuántas moléculas de agua se necesitarán para romper todos los enlaces peptídicos existentes? (0,25 puntos) ¿Cómo se denominan las enzimas que llevan a cabo este proceso de hidrólisis? (0,25 puntos).
1. EBAU-2019. En las biomoléculas que se citan a continuación, nombra los tipos de monómeros que las forman, así como los enlaces químicos que los unen:
A. Polisacáridos. (0,5 puntos)
B. Proteínas (aquí, cita también el resto de enlaces que estabilizan su estructura). (0,75p)
C. ADN (aquí, además, nombra los elementos que componen el monómero). (0,75 puntos)
2. EBAU-2017. Conteste a las siguientes cuestiones:
-
Dibuje un aminoácido indicando sus grupos funcionales. 1P
-
Indique dos diferencia y dos semejanzas entre almidón y celulosa.
3. EBAU-2021 2.- Respecto a las proteínas:
A. Defina los monómeros de las proteínas y escriba su fórmula general. (1 punto)
B. Enumere cuatro funciones de las proteínas y ponga un ejemplo de proteína para cada función (0,5 p).
C. Defina el proceso de desnaturalización y cite dos factores que causan este proceso. (0,5 puntos)
4. EBAU-2011 y 2014 SEP. Defina los siguientes términos:
-
Aminoáciodo.
-
Enlace peptídico.
-
Péptido.
-
Proteínas.
-
Enzima (EBAU-2011)
5. EBAU- Conteste los siguientes apartados:
-
Indique qué tipo de biomolécula representan las imágenes a y b. (0,5 puntos)
-
Explique qué enlace bioquímico se necesita para formar un polímero a partir de biomoléculas de la imagen a y mencione brevemente una de sus características. (0,5 puntos)
-
Indique qué polímeros se forman por unión de unidades de la imagen a y por la b. (0,5 puntos)
-
Describa brevemente una función de cada uno de estos polímeros. (0,5 puntos)
7. EBAU-2020. Estructura primaria (0.5 puntos) y secundaria de las proteínas (1.5 puntos).
8. EBAU-2015. Estructura secundaria en a-hélice de las proteínas. (2 puntos)
9. EBAU-2018. Estructura terciaria de las proteínas.
-
Concepto y enlaces que intervienen en su formación 1p
-
Especificidad de actuación y desnaturalización: importancia para su función de estas dos propiedades 1p
10. Nombra cuatro proteínas que realicen funciones distintas y aclara en qué consiste esa función.
MODELOS 2025
a. Indica la fórmula general de un aminoácido y señala cómo se llaman los aminoácidos que pueden ser sintetizados por nuestro organismo a partir de reacciones anabólicas (Calificación 1 punto)
b. ¿Por qué una ingesta inapropiadamente alta de alimentos ricos en colesterol supone un riesgo para la salud? (Calificación 1 punto) UD3 Lípidos
c. Indica cuál es el componente principal de la fibra alimentaria de la dieta, señalando qué efecto tiene en el organismo. (Calificación 0.5 puntos) UD2-anexo 1.



























Comentarios
Publicar un comentario